|
|
Февраль
2003 |
|
|
Февраль
2003 |
© Н.Д. Озернюк
ТЕМПЕРАТУРНЫЕ ГРАНИЦЫ ЖИЗНИ
Н.Д. Озернюк
Николай Дмитриевич Озернюк, доктор биологических наук, заместитель директора,
заведующий лабораторией биофизики развития
Института биологии развития им. Н.К.Кольцова РАН.Способность приспосабливаться к меняющимся условиям среды - одна из важнейших особенностей живых существ. Их распространение, численность и биоразнообразие в значительной мере определяются эффективностью адаптационных механизмов. Именно они позволяют организмам существовать в условиях, часто малопригодных для жизни, а иногда несовместимых, на первый взгляд, с нею.
Об уникальных адаптационных ресурсах организмов свидетельствует наличие жизни в самых невероятных условиях: на дне океана, на глубине 10 км под прессом огромного давления, и на высоте 12 км над уровнем моря, в крайне разреженной атмосфере. Некоторые бактерии и зеленые водоросли обитают в среде, соленость которой соответствует насыщенному раствору NaCl. Еще один удивительный пример адаптации - организмы, живущие в условиях экстремальных температур: одни виды - при температуре –50°С, другие - при +110°С. Уникальная категория таких организмов названа экстремофилами [1].
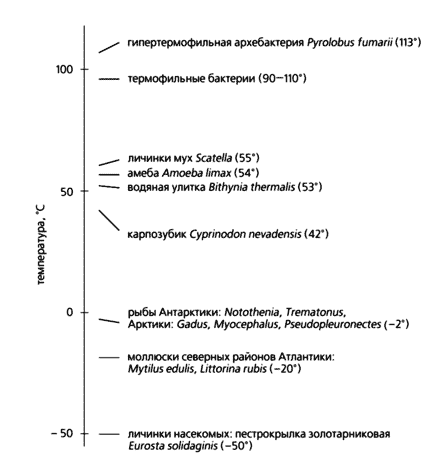
Температурные границы существования некоторых организмовИз всего многообразия адаптаций к отдельным экологических факторам (температуре, содержанию кислорода в среде, солености воды, освещенности, влажности) или к иным типам природной среды (высокогорью, морским глубинам, жизни в пещерах, в пустынях и др.) особенно интересны температурные. Ведь этот фактор воздействует на все живые существа; окружающая температура постоянно меняется, ее перепады в определенных районах бывают весьма значительными, и организмы, в особенности холоднокровные, должны к этому приспосабливаться. Жизнь при экстремальных температурах привела к формированию адаптационных механизмов, которые значительно расширили ее “температурные пределы” и позволили отдельным видам занять экологические ниши, практически непригодные для существования. Эти механизмы не позволяют кристаллам льда образовываться в теле личинок насекомых и разрушать их при –50°С. Напротив, термофильные бактерии - обитатели гидротермальных источников - живут при +110°С и их белки при этом не денатурируют. Вместе с тем температура среды - один из важных факторов, влияющих на распределение, численность и разнообразие видов в различных климатических зонах Земли.
Биоразнообразие и распространение видов
Известно, что разнообразие и суммарная численность организмов снижается от экватора к полюсам. Эта зависимость установлена для многих видов. Ее можно проиллюстрировать на примере рыб, населяющих крупные озера, реки и моря в разных широтах. По данным, собранным Е.К. Суворовым, А.П. Андрияшевым и Г.В. Никольским, в тропических озерах Виктория, Танганьика и Ньяса обитает 180, 214 и 250 видов рыб соответственно, а в северных озерах Онежском и Ладожском - 39 и 44. В южных морях Средиземном и Японском насчитывается примерно 500 и 600 видов рыб, тогда как в арктических Карском, Чукотском и море Лаптевых - 61, 38 и 31. Наиболее богатый видовой состав рыб в тропических реках: Амазонке - 1300 видов, Конго - 560, а в Волге и Оби их только 77 и 47.
Один из важнейших факторов, определяющих такую зависимость, - температура среды. Конечно, температура влияет на биоту вместе с другими биотическими и абиотическими факторами, в том числе и климатическими. Неблагоприятные температуры сказываются на разнообразии и распространении видов как непосредственно, влияя на размножение или развитие организмов, так и опосредованно, например воздействуя на их кормовую базу. Между границей ареала того или иного вида и изотермой имеется достаточно тесное соответствие. Распространение видов в различных климатических зонах ограничивается чаще всего не летальными и сублетальными температурами.
Какие стадии онтогенеза наиболее уязвимы при действии неблагоприятных температур? Самый чувствительный - период размножения, в котором отрицательный эффект проявляется на клеточном и тканевом уровнях. Так, пониженные температуры останавливают созревание гамет и снижают эффективность оплодотворения (табл.). Взрослые же особи способны выживать в наиболее широком диапазоне. Это обеспечивается наличием сформированных эффективных регуляторных механизмов (нервных и эндокринных), которые контролируют защиту от неблагоприятных температур. Эмбриогенез занимает промежуточное положение. Здесь из-за активного роста клеток быстро реализуются все возможные нарушения. В частности, низкие температуры ингибируют расхождение хромосом при делении клеток. Наиболее чувствительны гаструляция и вылупление зародышей из оболочек.
Разные организмы отличаются устойчивостью к перепадам температур. Большинство видов (эвритермные) легко переносят такие колебания. Они заселяют территории с большим диапазоном суточных и сезонных температурных колебаний. Другие виды (стенотермные) способны существовать лишь в узком диапазоне. К ним относятся обитатели влажных тропических лесов, морских глубин, пещер, а также жители высоких широт, где температура среды почти не меняется.
Механизмы температурных адаптаций
Какие механизмы лежат в основе приспособлений организма или отдельных его систем к неблагоприятным температурам? На молекулярном уровне они связаны с важнейшими внутриклеточными структурами и процессами. Речь идет об устойчивости белков и нуклеиновых кислот к экстремальным температурам, поддержании определенного агрегатного состояния биологических мембран, в первую очередь мембранных липидов, накоплении специфических соединений, предотвращающих образование кристаллов льда в клетках при отрицательных температурах, и др. [2, 3].
Разнообразные приспособления на всех уровнях организации живого - от молекулярного до экосистемного - формируются при помощи генотипического и фенотипического механизмов, которые обычно тесно переплетены. Генотипические адаптации складываются на протяжении множества поколений и связаны с естественным отбором - они “записаны” в геноме.
В ходе эволюции наиболее серьезная защита возникла от холода, поскольку даже небольшие отрицательные температуры могут губительно сказаться на организме теплокровных. Основные механизмы адаптации обусловлены действием биологических антифризов, поддержанием определенного агрегатного состояния мембранных липидов, а также мутациями, приводящими к аминокислотным заменам, которые обеспечивают необходимую гибкость белков.
Биологические антифризы. Устойчивость к низким температурам холоднокровных животных полярных областей определяется несколькими механизмами. У обитателей этих районов в биологических жидкостях (крови и лимфе) присутствуют биологические антифризы - пептиды и гликопротеины, препятствующие замерзанию воды в клетках. Кроме того, устойчивость к холоду обеспечивают многоатомные спирты - глицерин и сорбит. Если пептиды и гликопротеины останавливают рост микрокристаллов льда в клетках, то глицерин заменяет воду, которая при понижении температуры выводится во внеклеточную среду, где лед менее опасен. Глицерин, в частности, способствует стабилизации структуры белков и биологических мембран. Так, в теле моллюска Mytilus edulius, жителя литоральной зоны северной части Атлантического океана, при температуре до –20°С замерзает примерно 70% воды. Но, поскольку это внеклеточная вода, животные не погибают. У большинства морских животных в снижении температуры замерзания жидкостей участвуют присутствующие в крови глюкоза, аминокислоты и соли (прежде всего NaCl). Чем больше этих молекул в растворе, тем меньше у воды возможностей формировать кристаллы льда. Такой механизм называется коллигативным (заместительным).
Высокомолекулярные антифризы адсорбируются на образовавшихся мельчайших (и поэтому не опасных) внутриклеточных кристаллах льда, не давая им расти. Это очень эффективные криопротекторы: так, гликопротеины тормозят замерзание жидкостей в 200 - 300 раз сильнее, чем вещества, обладающие коллигативным механизмом действия. Высокомолекулярные антифризы составляют значительную часть от веса всех жидкостей, и в их присутствии температура замерзания раствора ниже, чем температура таяния. У антарктических рыб антифризы постоянно присутствуют в жидкостях тела (3.5% от веса всех биологических жидкостей), что определяется генотипическими механизмами. У других организмов они образуются в зависимости от сезонных колебаний температуры окружающей среды (фенотипическая адаптация). Синтез антифризов регулируется как экзогенно (при участии температуры среды и длительности светового дня), так и эндогенно (контролируется гипофизом).
Агрегатное состояние мембранных липидов. Интенсивность обмена веществ связана с клеточными мембранами, состояние которых зависит от мембранных липидов. Степень их вязкости определяет работу мембранных ферментов, транспорт ионов, синаптическую передачу и другие процессы. Липидный бислой обычно находится в жидкокристаллическом состоянии. Но при понижении температуры мембраны “затвердевают”, и большинство мембранных процессов замедляется. Необходимая степень вязкости мембран при низких температурах поддерживается за счет изменения соотношения липидных компонентов мембран - насыщенных и ненасыщенных жирных кислот в сторону последних (они делают липидный бислой более рыхлым). Соотношение этих двух типов жирных кислот может меняться в ходе синтеза и включения в молекулы фосфолипидов, а также за счет изменения числа двойных связей. Кроме того, насыщенные жирные кислоты могут превращаться в ненасыщенные при помощи фермента десатуразы, который активируется изменением температуры. У рыб, обитающих в холодных водах, ненасыщенных жирных кислот больше, чем у жителей умеренных и тропических широт. Это позволяет метаболическим системам животных Арктики и Антарктики нормально функционировать.
Аминокислотные замены. Серьезная проблема для обмена веществ у холоднокровных животных при низких температурах - снижение конформационной гибкости белков, существенно затрудняющее их функции. Поддержание определенной гибкости молекул достигается благодаря мутациям, вызывающим аминокислотные замены в белках животных, которые обитают в высоких широтах. Характер таких замен детально изучен на примере фермента лактатдегидрогеназы. При сравнении аминокислотных последовательностей этого белка, выделенного из скелетных мышц нототениевых рыб Антарктики и Южной Америки, было установлено, что замены локализованы в одной из a-спиралей, формирующих активный центр фермента. У большинства рыб умеренных широт в начале этой a-спирали находится остаток пролина, создающий определенную “жесткость” данному участку. У нототениевых рыб Антарктики пролин заменен на аланин, что обеспечило более гибкую структуру активному центру лактатдегидрогеназы, столь необходимую при пониженной температуре. Это только один из многих примеров генотипических адаптаций.
Компенсация энергетического обмена. Еще одно важное приспособление к холоду связано с компенсацией уровня энергетического метаболизма у холоднокровных. Так, в мышцах у полярных рыб концентрация митохондрий выше, чем у тех же видов или их близких родственников из умеренных или тропических широт. Как следствие этих различий, интенсивность дыхания полярных организмов выше по сравнению с обитателями умеренного пояса при расчете на одинаковую температуру, обычно 20°С. Другой тип компенсации метаболизма - более низкий энергетический барьер ферментативных реакций в тканях полярных животных, чем обитателей умеренного пояса.
Температурные границы жизни
Вернемся к примерам предельной устойчивости организмов к низким температурам среды. Так, феноменальной приспособленностью отличаются личинки золотарниковой пестрокрылки Eurosta solidaginis, зимующие в галлах на стеблях золотарника [4]. Располагаются они выше снежного покрова, а зимняя температура в местах их обитания –40° или даже –50°С. Насекомые в это время находятся в состоянии диапаузы, когда уровень обмена веществ, в том числе энергетический, резко снижен. До наступления холодов в теле личинок интенсивно синтезируется глицерин и сорбит, комбинированное действие которых и позволяет им перезимовать. Как уже отмечалось, глицерин заменяет воду, которая в больших количествах выводится из организма, а сорбит защищает ткани личинки по коллигативному механизму.
Изменение содержания различных веществ в теле личинок насекомых при различных температурах адаптации в течение нескольких недель в лабораторных условияхНе менее впечатляют термофильные бактерии, живущие при +113°С. Такая термоустойчивость характерна для архебактерии Pyrolobus funarii [5]. Сверхстабильная структура белков гипертермофильных бактерий (Thermotoga maritima и Pyrodictium occultum) обеспечивается аминокислотными заменами, в результате которых возникают новые внутримолекулярные взаимодействия (водородные связи, гидрофобные и ионные взаимодействия, солевые мостики). Таким образом, сверхстабильность белков определяется их первичной структурой, которая сформировалась на протяжении длительной адаптации к предельно высоким температурам. В качестве примера эффективности подобных механизмов можно привести фермент из гипертермофильных бактерий - амилопуллюланазу, которая сохраняет активность при +132°С [6].Термофильных бактерий от предельно высоких температур защищают также полиамины, стабилизирующие не только белки, но и их комплексы, в частности, бактериальный аппарат трансляции. Устойчивость термофилов связана не только с белками, но и нуклеиновыми кислотами, в особенности с тРНК. Известно, что пара оснований в РНК гуанин - цитозин более стабильна, чем пара аденин - уридин. У термофильных бактерий содержание гуанина и цитозина в тРНК выше, чем у мезофильных бактерий.
Фенотипические адаптации
При сезонных или более кратковременных (несколько недель) колебаниях температуры адаптационные механизмы имеют фенотипическую природу, они формируются на протяжении одного поколения, обратимы и “не записаны” в геноме. В этих случаях холоднокровные животные вынуждены приспосабливать свой метаболизм к новому температурному режиму.
Один из механизмов таких фенотипических адаптаций - синтез индуцированных температурой изоформ тех или иных ферментов, которые больше приспособлены к новым условиям. Например, в мозге радужной форели, находящейся в течение трех недель при низкой температуре, синтезируется специфическая “холодовая” изоформа ацетилхолинэстеразы. Образование индуцированных температурой изоформ эстераз показано также у других видов рыб. Однако такая индукция достаточно редкое событие.
Другой механизм связан с изменением функциональных свойств ферментов без изменения их изоформ. Так, в нашей лаборатории в Институте биологии развития им. Н.К.Кольцова РАН было обнаружено, что у рыб [7, 8] при адаптациях к низким и высоким температурам в течение нескольких недель меняются функциональные свойства ферментов. На примере лактатдегидрогеназы из скелетных мышц вьюна показано, что величина константы Михаэлиса (КМ), по которой можно судить о сродстве фермента с субстратом, зависит от ряда факторов, в том числе и от температуры: при оптимальной - КМ минимальна (т.е. фермент-субстратное сродство максимально), значит, фермент функционирует наиболее эффективно. У рыб, адаптированных к холодной воде, фермент-субстратное сродство максимально при низкой температуре. У рыб, помещенных в теплую воду, в течение двух-трех недель оптимум фермента постепенно смещается в сторону высокой температуры. Это говорит о том, что за данный срок фермент перестраивается на работу в новых условиях.
Температурная зависимость константы Михаэлиса (КМ) для лактатдегидрогеназы из мышц вьюнов, адаптированных к 5°С и к 18°С. Различное положение минимумов КМ (справа) исчезает после воздействия 3 М раствора мочевины.Итак, лактатдегидрогеназы из мышц вьюнов, живущих в холодной и теплой водах, отличаются по многим свойствам. “Холодная” форма фермента более стабильна по сравнению с “теплой” при воздействии разных факторов (pH, температуры, мочевины), но ни в том, ни в другом случае новые изоформы не синтезируются. Оказалось, что выявленные различия не связаны ни с взаимодействием фермента с лигандами, ни с его модификациями (чаще всего фосфорилированием). Однако самым поразительным было то, что после воздействия на обе формы слабых концентраций мочевины различия исчезали. Поскольку мочевина как денатурирующий агент действует на водородные связи, а также на гидрофобные и гидрофильные взаимодействия в молекуле белка, можно полагать, что у “холодной” и “теплой” форм эти связи и взаимодействия отличаются.Как можно объяснить такие необычные результаты? Вероятно, в мышцах рыб при низких и высоких температурах синтезируются формы лактатдегидрогеназы с несколько отличной пространственной структурой, поскольку их сборка происходит в разных условиях [9]. Речь может идти, в частности, о разном количестве водородных связей в двух формах фермента. Такое предположение подтверждают не только наши эксперименты, но и данные П.Л. Привалова, согласно которым при разных температурах (в их физиологическом диапазоне) количество водородных связей в белках отличается. Однако показать экспериментально наличие столь малых конформационных различий двух форм фермента пока крайне трудно.
Параллельно в нашей лаборатории продолжалась работа по анализу структуры генов лактатдегидрогеназы из мышц рыб, адаптированных к низкой и высокой температурам. Первоначально полагали, что их структура идентична. Однако при более детальном изучении выявились определенные различия в регуляторной части мРНК одной из форм фермента [10]. Возможно, что именно они и ответственны за сборку фермента.
Таким образом, изучение молекулярной природы фенотипических температурных адаптаций открывает новые механизмы и ставит новые вопросы. Это не удивительно, поскольку эффективные приспособления к различным природным факторам всегда носят комплексный характер и в их формировании участвуют различные внутриклеточные регуляторные механизмы.
Литература
1. Rothschild L.J., Mancinelli R.L. // Nature. 2001. V.409. P.1092 - 1101.
2. Александров В.Я. Реактивность клеток и белки. Л., 1985.
3. Хочачка П., Сомеро Дж. Биохимическая адаптация. М., 1988.
4. Storey K.B. et al. // J. Comp. Physiol. 1981. V.144. P.183 - 190.
5. Blochl E. et al. // Extremophiles. 1997. V.1. P.14 - 21.
6. Schuliger J.W. et al. // Mol. Mar. Biol. Biotech. 1993. V.2. P.76 - 87.
7. Клячко О.С. и др. // Биофизика. 1993. Т.28. С.596 - 601.
8. Озернюк Н.Д. Температурные адаптации. М., 2000.
9. Ozernyuk N.D. et al. // Comp. Biochem. Physiol. 1994. V.107B. P.141 - 145.
10. Смирнова Ю.А. и др. // Изв. РАН. Серия биол. 2002. ?3.