№3, 2004 г.
© Филиппович С.Ю., Бачурина Г.П., Крицкий М.С.
Супермодель нейроспора
С.Ю.Филиппович,
кандидат биологических наук
Г.П.Бачурина,
кандидат биологических наук
М.С.Крицкий,
доктор биологических наук
Институт биохимии им.А.Н.Баха РАН
МоскваЕсли бы в середине XIX в. во Франции булочнику сказали, что заразившая почти все пекарни страны оранжевая хлебная плесень через столетие станет для биологов одним из излюбленных объектов изучения, он бы ни за что не поверил. Помимо пекарен эта плесень столь же быстро распространяется на недавних пожарищах и в кратерах остывающих после извержения вулканов.
В 1927 г. микологи К.Шиэр и Б.Додж отнесли этот организм к новому роду Neurospora, принадлежащему к классу грибов аскомицетов, и описали его жизненный цикл. Род содержит десять видов, из которых наиболее хорошо изучена нейроспора густая (N.сrassa) [1]. В 1941 г. Д.У.Бидл и Э.Л.Тейтем получили для него первые биохимические мутанты. Исследуя N.crassa, они предложили гипотезу “один ген - один фермент” (один ген кодирует синтез одного специфического белка-фермента), которая теперь цитируется во всех учебниках по биохимии и генетике. В 1958 г. авторы получили Нобелевскую премию, и считается, что их работа смела барьеры между биохимией и генетикой. С этого момента началась эра биохимической генетики и молекулярной биологии. Нитчатый гриб Neurospora наравне с дрозофилой стал чрезвычайно удобной моделью эвкариотического организма для экспериментов в этих областях науки. Популярность нейроспоры объясняется довольно простой ее структурой, легкостью и быстротой культивирования в лабораторных условиях, позволяющего за короткое время исследовать несколько поколений.
В начале 60-х годов для упорядочения работы со все возрастающим количеством мутантов Neurospora в американском городе Канзасе был основан Грибной центр по хранению генетического материала этого организма (Fungal Genetic Stock Center - FGSC). Каталог имеющихся в центре более 7.5 тыс. грибных мутантов размещен во Всемирной паутине на сайте www.fgsc.net. В коллекции центра содержатся как генетически охарактеризованные клетки нейроспоры дикого типа и разнообразные мутантные штаммы, так и штаммы гриба, выделенные из более 4 тыс. природных популяций. Научные исследования оранжевой плесени приобрели такой размах, что параллельно с созданием Грибного центра стали созываться специализированные конференции, посвященные нейроспоре, и выпускаться ежегодник “Neurospora Newsletter”. С 1986 г. в связи со значительным ростом числа работ по генетике грибов к названиям конференции и ежегодника было добавлено слово “генетический” - “Fungal Genetics Conference” и “Fungal Genetics Newsletter”.Жизненный цикл Neurospora crassa. Стадии 1-4 - от прорастания аскоспор до оплодотворения - вегетативная фаза; стадии 4-8 - от оплодотворения до созревания аскоспор - половая фаза. Черные аскоспоры (17x26 мкм) выстреливают из перитеция. Прорастающая аскоспора показана с гифами, растущими с обоих концов (1). Мицелий представлен нитчатыми ветвящимися многоядерными гифами, разделенными клеточными перегородками, через которые способны проходить ядра и цитоплазма (2). На мицелии образуются вегетативные споры (3) двух типов - многоядерные макроконидии и одноядерные микроконидии. Скручиваясь вокруг аскогониальных клеток, гифы образуют клубок и формируют протоперитеций (4). После оплодотворения гаплоидные ядра А- и а-типов делятся (5, 6), сливаются и затем происходит мейоз (7), завершающийся образованием асков в перитеции (8) [1].С использованием различных мутантов N.crassa были сделаны крупные открытия в генетике. Одно из них выполнено в лаборатории Э.Селкера в 1987 г.: обнаружены уникальные для грибов специфические RIP-мутации (от англ. repeat-induced роint), затрагивающие гены в удвоенных сегментах ДНК перед началом мейоза. Не вдаваясь в подробности, заметим, что существование такого рода мутаций - важный защитный механизм генома эвкариот [2]. Вершиной же генетических исследований N.crassa, конечно же, стала расшифровка генома этого организма, законченная в 2003 г. совместными усилиями более 70 ученых [3]. Установлено, что семь хромосом гриба содержат около 10 тыс. генов. Это в два раза больше, чем у дрожжей Schizosaccharomyces pombe и лишь на четверть меньше, чем у плодовой мушки дрозофилы. Анализ генных последовательностей позволил обнаружить неожиданные особенности биологии нейроспоры, касающиеся работы генов вторичного метаболизма и различий в действии Са2+ сигнализации по сравнению с растениями и животными. Кроме того, выяснилось, что RIP-мутации могут оказывать существенное влияние на эволюцию генома, резко замедляя появление новых генов и приводя к образованию генома с необычно низким содержанием близкородственных генов.
Как и все аскомицеты, нейроспора способна размножаться двумя различными путями - бесполым (за счет спор, образуемых отдельной особью) и половым (соединением двух особей). Для исследователей крайне важно, что фазы развития N.crassa четко различимы морфологически, а их смена регулируется совершенно определенными факторами среды (например, действием воды, света и голода). Гриб способен расти на среде, состоящей из неорганических солей, витамина биотина и источника углерода. Исключая или добавляя определенные элементы питания, можно следить за соответствующими изменениями морфогенеза этого аскомицета. Так, нейроспора густая - один из наиболее простых эвкариотических организмов - стала ценнейшей моделью для изучения явлений клеточной дифференцировки, особое место среди которых занимают процессы, регулируемые светом.
Конидии N.crassa (слева) и протоперитеций на ее мицелии.
Фото М.Л.Спрингера
Микрофотографии публикуются с любезного разрешения
Американского общества микробиологов (http://www.
microbelibrary.org).
Обычно жизненный цикл N.crassa начинается с того, что спора прорастает на подходящем субстрате, образуя мицелий. При росте в поверхностной культуре ветвящиеся гифы гриба покрывают среду, в состав которой входит агар-агар, равномерной белой пленкой. В оптимальных условиях мицелий способен расти со скоростью 10 см в день. Для того чтобы отделить мицелий от агар-агара и использовать его для дальнейших манипуляций, поверхность среды в чашках Петри перед внесением спор выстилают целлофановой пленкой. При бесполом развитии на мицелии через несколько дней образуются воздушные гифы, на которых формируются круглые вегетативные споры макроконидии, обычно называемые просто конидиями. Их интенсивная оранжевая окраска обусловлена присутствием каротиноидных пигментов, в основном - нейроспороксантина. Мицелий штаммов гриба дикого типа со временем также становится оранжевым. При половом развитии на мицелии образуются предшественники женских плодовых тел - протоперитеции, в которых происходит слияние с клетками гриба (конидиями или мицелием) противоположного типа спаривания (их у гриба может быть два - А и а). Через сутки они увеличиваются в размере, темнеют и превращаются в женские половые структуры - перитеции. Спустя несколько дней в них созревают черные половые споры - аскоспоры. В каждом перитеции по 200-400 сумок (асков), содержащих по восемь овальных аскоспор.Каким же образом гриб выбирает путь развития и какие метаболические процессы, протекающие в клетке, за это ответственны? До начала нашей работы молекулярные механизмы, лежащие в основе переключения с бесполого на половой путь развития и обратно, не были изучены не только у нейроспоры, но и у других грибов.
Замечено, что синий свет влияет на образование половых и вегетативных спор N.crassa, при этом крайне важен состав среды, на которой растет аскомицет. Мы выяснили, что при половом пути развития гриба на среде, из которой удален источник азота, освещение синим светом приводит к увеличению образования протоперитециев и одновременно с этим к уменьшению формирования конидий. При бесполом же спорогенезе в условиях голода по углероду синий свет, напротив, стимулирует образование конидий. Напомним, что их созревание сопровождается накоплением каротиноидных пигментов. Вместе с тем, регуляцию их биосинтеза можно наблюдать и на более простой системе - фотокаротиногенезе в вегетативном мицелии, не сопровождающемся морфологическими изменениями.
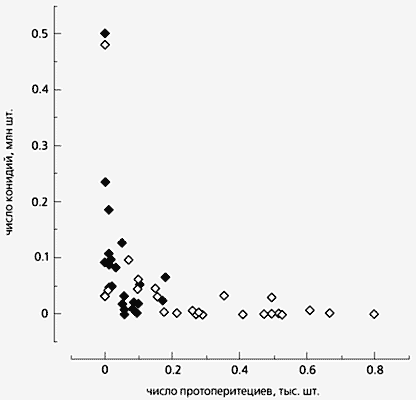
Образование конидий и протоперитециев после обработки мицелия гриба 5-азацитидином
в темноте (темные символы) и после освещения [9].Известно, что процессы развития и клеточной дифференцировки контролируются энзиматическим метилированием азотистых оснований ДНК (в основном цитозина), для краткости обычно именуемым метилированием ДНК [4]. Надо сказать, что основными объектами для исследований в этой области ранее служили клетки млекопитающих и растений, однако для них мутации по ДНК-метилированию часто летальны. Оранжевой плесени и здесь нет равных: поскольку для нее метилирование ДНК не столь обязательный процесс и возможно получение жизнеспособных мутантов с его нарушением. Считается, что модификация хроматина (в состав которого, как известно, помимо ДНК входят еще и специфические белки - гистоны) и регуляция экспрессии генов тесно связаны не только с введением и удалением ацетильных остатков в гистоновых белках, но и с метилированием и деметилированием цитозина в ДНК. Несмотря на то, что геном N.crassa метилирован слабо, содержание 5-метилцитозина у гриба варьирует по мере превращения прорастающей конидии в вегетативный мицелий, что говорит о наличии определенной связи между уровнем метилирования ДНК и генной экспрессией [5]. Возникновение RIP-мутаций у гриба также связывают с метилированием ДНК, но эти мутации вряд ли влияют на его выбор способа развития, так как происходят они только на ранних стадиях мейоза.
В качестве инструментов для оценки возможного участия метилирования ДНК в регуляции путей развития N.crassa были выбраны специфические ингибиторы этого процесса - 5-азацитидин и метотрексат. Встраивание в молекулу ДНК 5-азацитидина вместо цитидина делает ее недоступной для ферментов метилтрансфераз, и таким образом нарушается нормальный процесс метилирования остатков цитозина. Метотрексат проявляет ингибирующее действие на более широкий круг реакций метилирования, в частности на биосинтез пуринов и тимина. Помимо этого, обработка клеток 5-азацитидином может вызывать активацию так называемых молчащих генов, модификацию хроматина и ингибирование различных стадий транскрипции, что, возможно, происходит вследствие деметилирования ДНК.
Учитывая наши довольно ограниченные финансовые возможности и помня старый добрый принцип “голь на выдумки хитра”, мы разработали достаточно простую схему эксперимента. Действие ингибиторов на светочувствительные этапы половой и бесполой споруляции N.crassa начали изучать на штаммах дикого типа, любезно предоставленных Грибным центром FGSC. После трех суток роста в темноте целлофановый диск с мицелием гриба переносили на свежую безазотную среду, в которую предварительно добавляли 5-азацитидин. Спустя сутки одну часть содержащихся в темноте чашек Петри освещали в течение двух минут синим светом (именно такой режим оптимален для запуска формирования протоперитециев на среде с дефицитом азота), а другую - использовали в качестве контроля (продолжали держать в темноте). Через двое суток под бинокулярным микроскопом при красном свете подсчитывали количество образовавшихся протоперитециев, а еще через два дня темновой инкубации культур с чашек смывали конидии и определяли их количество, для чего предварительно высеивали их на полноценную среду.
В условиях азотного голодания добавление 5-азацитидина в широком диапазоне концентраций (от 3 до 300 мкМ) приводило к ингибированию формирования протоперитециев и увеличению выхода конидий. Влияние синего света и ингибитора ДНК-метилирования на образование вегетативных спор было очень сильным. Так, свет подавлял конидиогенез более чем в 100 раз, а обработка 5-азацитидином в этих условиях приводила к более чем 700-кратному возрастанию количества конидий по сравнению с контрольным мицелием. Таким образом, после обработки мицелия 5-азацитидином, как в темноте, так и после действия света, образование протоперитециев сопровождалось обратнопропорциональным уменьшением количества конидий.
Накопление в клетках N.crassa каротиноидных пигментов - часть программы индивидуального развития этого организма. Образование каротиноидов, напомним, сопровождает процесс конидиогенеза и, хотя генетическое нарушение синтеза пигментов не препятствует формированию спор, их отсутствие у мутантов группы albino заметно снижает устойчивость конидий к действию ультрафиолета. Ингибиторы метилирования ДНК влияют на фотокаротиногенез гриба гораздо слабее, чем на образование репродуктивных структур [6]. Обработка мицелия N.crassa 5-азацитидином (3-30 мкМ) приводила к стимуляции фотокаротиногенеза, но не более чем на 30%, а дальнейшее повышение его концентрации тормозило не только этот процесс, но и рост клеток. Интересно, что метотрексат - антиметаболит фолиевой кислоты и ингибитор более широкого спектра действия - действовал практически так же.
Итак, в условиях азотного голодания метилирование ДНК становится одним из механизмов регуляции активности генома при формировании репродуктивных структур грибов. Его влияние затрагивает, по-видимому, ранние этапы выбора полового или бесполого пути развития N. crassa и в меньшей степени распространяется на контроль активности генов, экспрессия которых происходит на поздних стадиях дифференцировки. Принимая во внимание низкую степень метилирования ДНК N.crassa, можно предположить, что лишь небольшая часть генома ответственна за выбор грибом полового или бесполого пути развития.
Ранее было установлено (в том числе и в нашей лаборатории), что у N.crassa синий свет влияет не только на образование аскоспор и конидий, но сказывается и на других функциях гриба [7]. Среди них - электрогенез клеточных мембран, положительный фототропизм перитециев и изменение их полярности, а также ингибирование или сдвиг циркадных (суточных) ритмов конидиогенеза. Выяснилось, что все эти разнообразные реакции оранжевой плесени на синий свет опосредованы действием генов white collar-1 и white collar-2, а ядерный белок WC-1, кодируемый геном wc-1, представляет собой фоторецептор синего света у этого гриба, содержащий флавиновый хромофор, ФАД (флавинадениндинуклеотид) [8]. Открытие такого фоторецептора - одно из выдающихся достижений последнего времени, так как это пример принципиально новой биохимической функции коферментов в белках - фотосенсорной.
Поэтому мы решили проверить, не связана ли данная система и со светозависимым метилированием ДНК? Для этого описанный выше ингибиторный анализ был проведен на клетках wc-1 FGSC и wc-2 FGSC штаммов N.crassa. Мицелий этих мутантов всегда белый (в нем не происходит свойственный дикому типу синтез каротиноидов, хотя в конидиях биосинтез этих пигментов протекает без изменений). Оказалось, что эти штаммы - “слепые”, иными словами, в отличие от клеток дикого типа, синий свет не вызывает у них увеличения образования протоперитециев и уменьшения формирования конидий. Поэтому можно предположить, что гены wc-1 и wc-2 участвуют в регуляции образования репродуктивных структур, вызванного синим светом при росте N.crassa на среде без азота. Сравнительный анализ формирования протоперитециев в темноте и после кратковременного освещения мицелия синим светом свидетельствует об усилении ингибирования процесса по мере увеличения концентрации 5-азацитидина в среде как для клеток дикого типа, так и для wc-мутантов. В противоположность этому при бесполом развитии после обработки этим же ингибитором лишь у wc-мутантов N.crassa в световом и темновом вариантах опыта и у дикого штамма, развивающегося в темноте, результаты оказалась сходными. Вместе с тем, в освещенном синим светом диком штамме в тех же условиях происходило резкое увеличение образования конидий по сравнению с необработанными ингибитором клетками. Из этого следует, что гены wc-1 и wc-2 участвуют в процессе метилирования ДНК во время светозависимого конидиогенеза N.crassa.
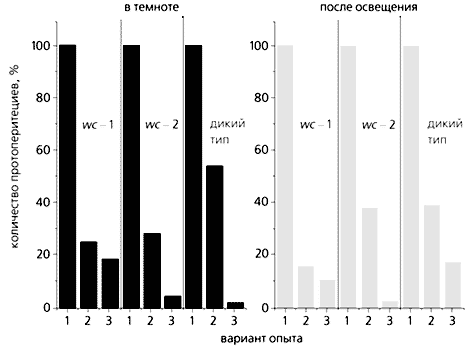
Влияние 5-азацитидина на образование протоперитециев (вверху) и конидий у разных штаммов N.crassa в условиях азотного голодания. Варианты опыта: 1 - контроль (без обработки ингибитором), принятый за 100%; 2 - в присутствии 30 мкМ 5-азацитидина; 3 - в присутствии 300 мкМ 5-азацитидина.Таким образом, впервые удалось установить существование связи светозависимых процессов дифференцировки с метилированием ДНК [9]. Это выражается в том, что свет и ингибитор 5-азацитидин оказывают прямо противоположное воздействие на образование репродуктивных структур N.crassa. Можно заключить, что механизм, диктующий окончательный выбор развития гриба (в условиях азотного голодания) по половому либо по бесполому пути, чувствителен к синему свету и, судя по данным ингибиторного анализа, связан с метилированием ДНК. Можно предположить, что при высоком уровне метилирования ДНК на мицелии N.crassa образуются протоперитеции, а гипометилирование генома сдвигает баланс в пользу формирования конидий. Функционирование генов wc-1 и wc-2 связано со светозависимым образованием репродуктивных структур, причем при бесполом пути развития гриба в этом задействован процесс метилирования ДНК.Полученные результаты также важны и для практики, поскольку открывают перспективу управления процессами развития грибов при помощи изменения состава среды, действия синего света и ингибиторов метилирования ДНК. Это особенно значимо для оптимизации процессов в биотехнологии, использующей грибы в качестве продуцентов биологически активных соединений.
В связи с этим стоит также упомянуть о новом применении ингибиторов метилирования ДНК с использованием клеток нейроспоры в качестве модели для тестирования их действия [10]. Американские ученые исследовали способность зебуларина (аналога цитидина) реактивировать молчащие гены гриба и это свойство ингибитора затем использовали при работе с опухолевыми клетками млекопитающих для реактивировации генов-супрессоров. Известно, что эти гены в активном состоянии блокируют развитие многих раковых опухолей, поэтому если получится подобрать регулирующие их активность ингибиторы метилирования ДНК, то возможно, что в будущем это поможет в борьбе с этими заболеваниями.
Работа выполнена при поддержке Российского фонда фундаментальных исследований.
Проекты 98-04-48328а, 01-04-468а и 02-04-08064.Литература
1. Perkins A.D., Radford A., Sachs M.S. The Neurospora Compendium. Chromosomal Loci. San Diego, 2001.
2. Selker E.U., Tountas N.A., Cross S.H. et al. // Nature. 2003. V.422. №6934. P.893-897.
3. Galagan J.E., Calvo S.E., Borkovich K.A. et al. // Nature. 2003. V.422. №6934. P.859-868.
4. Ng H.-H., Bird A. // Current Opinion in Genetics and Development. 1999. V.9. №2. P.158-163.
5. Russel P.J., Rodland K.D., Rachlin E.M., McCloskey J.A. // J. Bacteriol. 1987. V.169. №6. P.2902-2905.
6. Крицкий М.С., Филиппович С.Ю., Афанасьева Т.П. и др. // ДАН. 2001. Т.378. №5. C.691-693.
7. Potapova T.V., Levina N.N., Belozerskaya T.A. et al. // Arch. Microbiol. 1984. V.137. №1. P.262-265.
8. He Q., Cheng P., Yang Y. et al. // Science. 2002. V.297. P.840-843.
9. Kritsky M.S., Russo V.E.A., Filippovich S.Yu. et al. // Photochem. Photobiol. 2002. V.75. №1. P.79-83.
10. Cheng J.C., Matsen C.B., Gonzales F.A. // J. Nat. Cancer Inst. 2003. V.95. №5. P.399-409.