№4, 2004 г.
© Брегадзе В.И., Сиваев И.Б.
Лекарство-снайпер,
или
Химический прицел для нейтронаВ.И.Брегадзе, И.Б.Сиваев
Владимир Иосифович Брегадзе, д.х.н., зав. лаб. алюминий- и борорганических соединений
ИНЭОС им.А.Н.Несмеянова РАН.
Игорь Борисович Сиваев, к.х.н., с.н.с. той же лаборатории.
Яды входят в состав лекарств, как пороки в состав добродетелей.
Ф.Ларошфуко
Одна из характерных примет современной науки - объединение смежных областей знания. Именно по этой причине наиболее интересные результаты достигаются на стыке наук. Рассказ пойдет о том, как решалась важная медицинская проблема, которая свела воедино усилия специалистов четырех научных дисциплин: медицины, биологии, химии и ядерной физики.
От грубых инструментов к утонченным
Супруги Пьер Кюри и Мария Склодовская-Кюри, открывшие в 1898 г. радий, уже через год стали изучать действие радиоактивного излучения на живые ткани и затем ввели в медицинскую практику облучение препаратами радия для борьбы с опухолевыми клетками. По существу, появилась новая область медицины - радиотерапия. Элемент №88 вдохновил научный мир на создание специальных, радиевых, институтов: первый возник в 1914 г. в Париже, позже появились в Варшаве и Вене. В начале 1922 г. в Петрограде В.И.Вернадский создал такой же институт, где было организовано лечение онкологических заболеваний.
Одновременное действие трех видов радиоактивного излучения (a-, b- и g-лучей) разрушало не только опухолевые, но и здоровые клетки. Поэтому использование радиевых препаратов в медицинских целях требовало исключительно аккуратной дозировки, которую находили опытным путем. Иного способа в то время не существовало. Все это напоминало, по словам современников, ремонт часового механизма с помощью слесарных инструментов.
Научный подход к применению радиоактивного излучения в терапии рака оказался возможным благодаря стремительному развитию ядерной физики в 30-х годах XX в. В 1932 г. Дж.Чедвик открыл нейтрон (за что получил Нобелевскую премию), а в 1934 г. Д.Ли обнаружил, что захват нейтрона ядром сопровождается испусканием g-кванта. Эти открытия стали основой ядерной медицины - научного направления на стыке физики, химии и медицины. В дальнейшем было изучено взаимодействие нейтронов с ядрами различных элементов. Результаты привели в 1936 г. Г.Лочера к оригинальной идее лечения онкологических заболеваний [1]: вначале следует ввести в раковые клетки препарат, содержащий стабильный изотоп бора 10В, а затем обработать его потоком тепловых нейтронов невысокой энергии. В итоге атом бора, захватив нейтрон, превращается в радиоактивный изотоп, который распадается с образованием лития, a-частицы (ядра гелия) и g-кванта (рис.1).
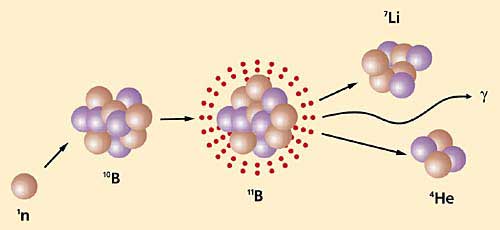
Рис.1. Принцип бор-нейтронозахватной терапии.
Так как энергия g-квантов составляет не более 17% всей выделяющейся энергии, основное лечебное действие оказывают a-частицы и ядра 7Li. И те, и другие обладают тем преимуществом, что длина их пробега крайне низка - соизмерима с размером клетки, - потому здоровые ткани не разрушаются. Следовательно, предложенный метод (он получил название бор-нейтронозахватной терапии [2, 3]) позволяет устранить главный недостаток.
Но не затронет ли нейтронное излучение здоровые клетки? Оказывается, нет. В данном случае бор как потенциальный источник a-частиц использован не случайно. Атомы бора имеют сечение захвата тепловых нейтронов на 4-7 порядков выше, чем атомы углерода, водорода, кислорода, азота, входящие в состав биологических молекул, из которых построены все клетки. Таким образом, губительное для тканей вторичное излучение не будет оказывать на них разрушающего действия.
Из общих соображений понятно, что препараты, вводимые в ткани живого организма, должны быть водорастворимы и не токсичны. Поэтому исследователи в начале 50-х годов сосредоточили свое внимание на борной кислоте и ее производных, так называемых препаратах первого поколения. Однако в клинических испытаниях они оказались неэффективными, прежде всего, потому, что не обеспечивали необходимую (довольно высокую) концентрацию атомов бора в опухолях. Значит, нужны были соединения бора с большим числом его атомов в молекуле, способные проникать в раковые клетки и задерживаться там, но не обладающие выраженной биологической активностью.
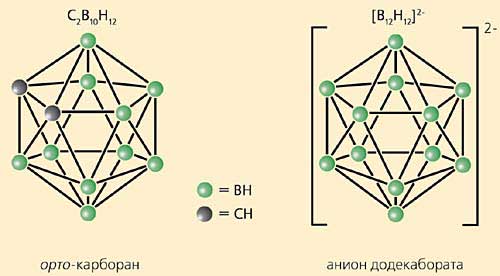
Рис.2. Каркасные бороводороды.
Поиск таких соединений неизбежно приводит к полиэдрическим гидридам бора, среди которых наиболее известен орто-карборан (рис.2), ставший эмблемой химии бора в конце 20-го столетия. Появление орто-карборана буквально открыло в химической науке новую главу, посвященную соединениям, которые построены с помощью нетрадиционных трехцентровых связей и обладают объемной ароматичностью. Превращения карборана изучены весьма детально, и потому пути его направленной химической модификации во многом определены. Это, естественно, привлекает химиков-синтетиков, вовлеченных в нейтронозахватную гонку [4, 5].
Тем не менее карборан был не лучшим кандидатом на роль “захватчика” нейтронов, поскольку имел некоторые недостатки. Прежде всего, это соединение гидрофобно, что делает необходимым дополнительное введение различных гидрофильных групп, которые позволят в конечном итоге получить водорастворимый препарат. Подобная химическая модификация карборана существенно усложняет и удорожает синтез целевых соединений, а в ряде случаев приводит к появлению нежелательной побочной биологической активности.
Больше подходили анионные гидриды бора [6], в первую очередь додекаборат [B12H12]2– (см. рис.2). Он представляет собой многогранник с такой же структурой и тем же электронным строением, что и у его знаменитого родственника - орто-карборана С2B10H12. Додекаборат обладает рядом преимуществ, позволяющих считать его более предпочтительным для радиотерапевтической цели. Во-первых, он содержит еще больше атомов бора, чем карборан. Во-вторых, способы получения этого гидрида весьма многочисленны (он образуется в той или иной концентрации практически во всех пиролитических реакциях бороводородов), благодаря чему его довольно легко получать из исходных соединений, обогащенных изотопом 10В (на основе которого, собственно говоря, формируется сам принцип бор-нейтронозахватной терапии). К тому же, додекаборат [B12H12]2– гидрофилен и малотоксичен [7]. Однако и он не идеален: все атомы бора в нем эквивалентны, и, в отличие от карборана, он не имеет четко выраженного реакционного центра, реакции замещения в этом соединении изучены в меньшей степени. Следовательно, необходимо было разработать методы синтеза производных додекабората.
Природу вводимых функциональных групп, которые должны обеспечить накопление препарата в опухолевых клетках, мы определяли, согласуясь с опытом биохимиков. Наиболее предпочтительными оказывались амино- (–NH2), изоцианатные (–NCO), карбоксильные (–СООН) и изотиоцианатные (–NCS) группы. Помимо того, предстояло решить, как именно должны располагаться вводимые функциональные группы относительно боранового ядра. К началу нашей работы уже имелся клинический опыт использования в бор-нейтронозахватной терапии додекабората с тиольной группой - Na2[B12H11SH], относящегося ко второму поколению препаратов. К сожалению, он обладает низкой избирательностью накопления в опухолевых клетках. Чтобы устранить электронное и стерическое влияние додекаборатного фрагмента на активную группу, обеспечивающую связь с биомолекулами, мы наметили располагать ее на некотором удалении от боранового ядра, отодвинув с помощью цепочки из трех-пяти атомов.
Упражнения с каркасными бороводородами
Обозначив основное направление исследований, мы занялись поиском конкретных путей его осуществления. Нам удалось разработать удобный препаративный метод присоединения различных алкоксигрупп к борановому каркасу действием активирующего агента - кислоты Льюиса (например, эфирата трехфтористого бора BF3·Et2O) - в тетрагидрофуране и различных нуклеофилов (рис.3) [8]. На первой стадии молекула тетрагидрофурана присоединяется к додекаборановому ядру с образованием ключевого интермедиата синтеза - оксониевого производного. Затем в реакцию вводится один из нуклеофилов и интермедиат раскрывается, образуя тетраметиленоксидную цепочку –O(CH2)4–. Такой метод позволил получить соединения, в котором функциональная группа (аминная, карбоксильная либо остаток аминокислоты), связана с борным остовом удлиняющей цепочкой –O(CH2)4– (см. рис.3).
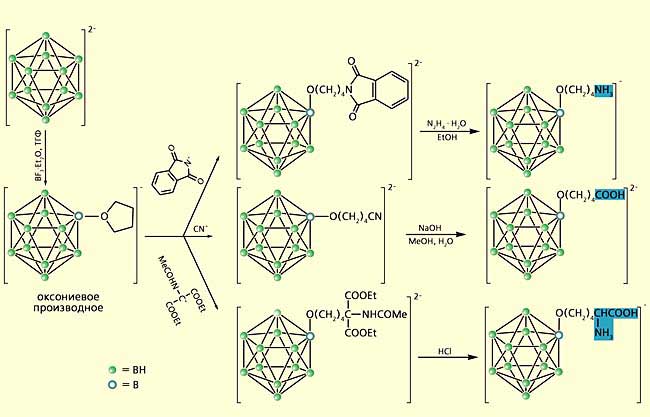
Рис.3. Схема получения алкоксипроизводных додекабората с функциональными группами.
Здесь, в правой колонке, приведены соединения с аминной и карбоксильной группами,
а также с остатком аминокислоты глицина (выделены цветом).Заметим: основной объект наших экспериментов - борановое ядро - формально принадлежит к “ареалу” неорганической химии. Но мы не смогли бы осуществить главную часть своих замыслов без привлечения мощного арсенала органической химии.
Исследовав более детально химические свойства додекабората, мы решили несколько разнообразить стратегию синтеза и стали присоединять удлиняющие цепочки с функциональными группами не через атом кислорода, а через азот, и вводить в состав молекулы ароматическое кольцо [9] (рис.4). В качестве исходного соединения для последующих синтезов был использован ранее полученный аминододекаборат (рис.4,а), а из него синтезированы основания Шиффа (рис.4,б). После их восстановления образовывались производные, содержащие бензиламиновую удлиняющую цепочку –NHCH2C6H4–. За счет трансформации функциональных групп, связанных с ароматическим кольцом, мы еще больше расширили диапазон вводимых групп, в частности, включив в их число изотиоцианатную –NCS (рис.4,в). Именно она, как выяснилось, обеспечивает эффективное связывание молекулы с различными белками, а тем самым и селективную доставку атомов бора в опухолевую клетку.
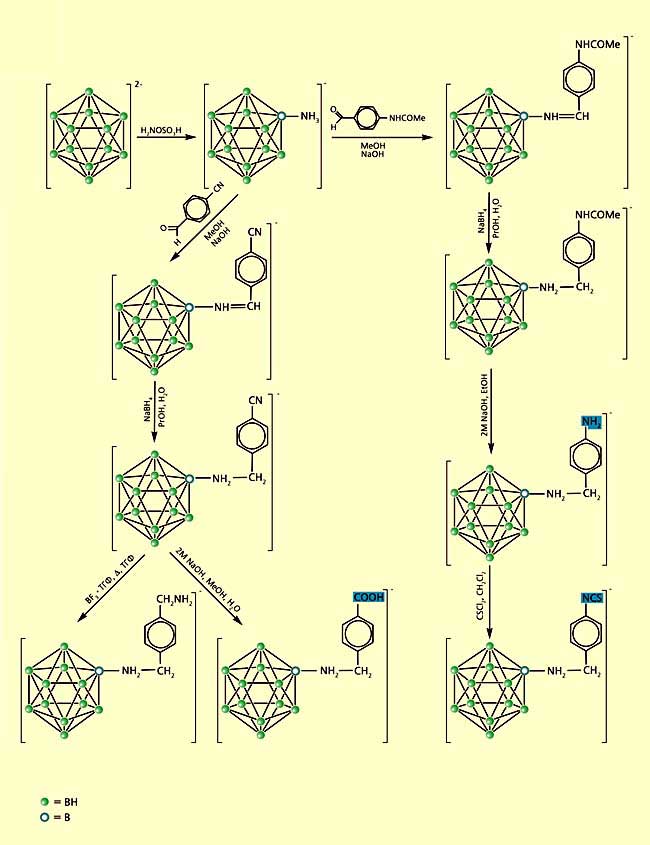
Рис.4. Схема синтеза аминопроизводных додекабората
с функциональными группами - аминной, карбоксильной и изотиоцианатной
(внизу справа, выделены цветом).Отечественная бор-нейтронозахватная терапия, объединила усилия химиков, фармакологов, онкологов и физиков-ядерщиков. Так, например, В.Ф.Хохловым, сотрудником Государственного научного центра “Институт биофизики”, организован научный коллектив, в который, кроме нас, химиков, вошли: В.Н.Кулаков (из того же центра), занимающийся получением новых препаратов и их лекарственных форм; В.Н.Митин (сотрудник Онкологического научного центра РАМН), проводящий предклинические испытания на собаках со спонтанной меланомой; А.А.Портнов и К.Н.Зайцев, отвечающие за работу на исследовательском реакторе Московского инженерно-физического института (МИФИ). Необходимость детальных исследований определяется особенностями каждого ядерного реактора. В настоящее время проводятся предклинические испытания на реакторе МИФИ с использованием раковых клеток, мелких и крупных животных с перевитыми и спонтанными опухолями. Изучается фармакологическая кинетика нейтронозахватных препаратов [10]. Исследования ведутся при финансовой поддержке Российского фонда технологического развития и Международного научного технического центра.
Сам метод, несмотря на его давнюю историю, в нашей стране еще не испытан на людях, но опробован на собаках. Так, спаниель с опухолью на верхней губе был полностью излечен путем введения лечебного препарата и дальнейшего облучения в реакторе МИФИ. В кругу исследователей, занимающихся лечением онкологических заболеваний, спасенная собака (рис.5) не менее знаменита, чем разрекламированная на весь мир клонированная овечка Долли. Будем надеяться, что отечественная технология бор-нейтронозахватной терапии войдет и в клиническую практику.
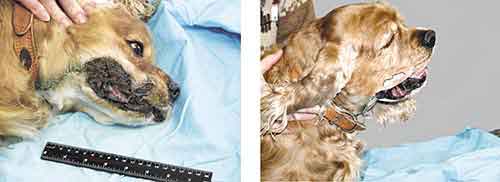
Рис.5. Собака до и после бор-нейтронозахватной терапии.
Не все синтезированные на сегодня соединения прошли полные испытания, а мысль исследователей идет далее. Успех лечения, как упомянуто, во многом определяется достижением необходимой терапевтической концентрации 10В в клетках опухоли. А поскольку оно в значительной степени зависит от количества атомов бора в молекуле, мы приступили к синтезу нейтронозахватных агентов с более высоким содержанием бора.
С этой целью мы объединили каркасные молекулы - додекаборановое ядро и орто-карборан - в единую систему, связав их тетраметиленоксидным мостиком, как при синтезе алкоксипроизводных [11] (рис.6, вверху). В результате была получена молекула из 22 атомов бора. Ее легко модифицировать, введя необходимые функциональные группы или через атомы бора, или через незадействованный еще второй атом углерода в карборановом фрагменте.
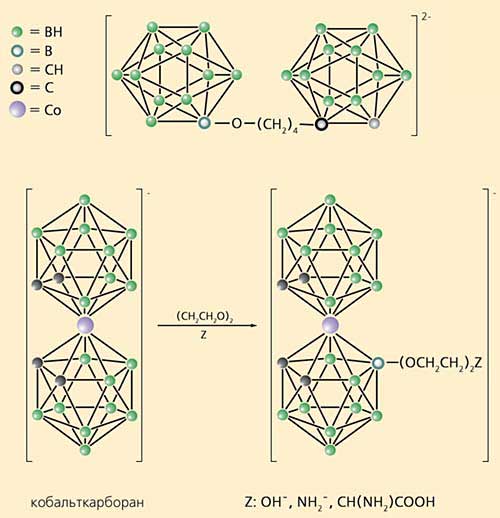
Рис.6. Молекулы с высоким содержанием атомов бора.
Отдельные стадии синтезов не приведены, так как они воспроизводят схемы, показанные на рис.3.Существует и принципиально иной способ объединения бороводородных многогранников. Если у карборанового ядра удалить одну вершину ВН, то возникает незамкнутая структура в виде двухзарядного аниона [C2B9H11]2–, содержащая на открытой грани три атома бора и два углерода. Полученное соединение по свойствам очень напоминает анион циклопентадиенила [С5Н5]– (главное действующее лицо в химии p-комплексов переходных металлов). Подобно такому аниону незавершенный карборановый каркас с помощью открытой грани способен образовывать с ионами переходных металлов сандвичевые комплексы - металлокарбораны (см. рис.6, внизу слева), напоминающие широко известный ферроцен.
Введение функциональных групп, необходимых для последующего связывания с биомолекулами, осуществляли по той же схеме, что и при модификации алкоксипроизводных додекабората (см. рис.3). На первой стадии каталитически присоединяется диоксан (ранее, в синтезе алкоксипроизводных, его роль исполнял тетрагидрофуран), затем при действии нуклеофильных реагентов диоксановое кольцо размыкается, образуя цепь (OCH2CH2)2. На ее конце и располагаются гидроксильная, аминная, нитрильная или некоторые другие группы [12] (рис.6, внизу справа). Поскольку все полученные соединения имеют ионный характер, проблема гидрофобности карборанового ядра в данном случае снята.
Бор-нейтронозахватную терапию можно использовать для лечения не только онкологических заболеваний, но и иных патологий, например ревматоидного артрита, которым страдает более 1% взрослого населения планеты. Предполагают, что такой способ может составить конкуренцию современным хирургическим методам или даже полностью их заменить.
Иные грани многогранников
Помимо бор-нейтронозахватной терапии существуют также чисто медикаментозные методы лечения онкологических заболеваний, причем именно такая практика наиболее широко распространена. В настоящее время для этой цели применяют различные препараты, в том числе цисплатин (комплексное соединение платины) и 5-фторурацил. Исходя из результатов недавних исследований, особенно эффективно уничтожают раковые клетки органические производные олова, но, в отличие от упомянутых веществ, они токсичны.
Оказалось, что бороводородные многогранники обладают еще одним замечательным свойством - они резко снижают токсичность соединений олова, сохраняя их противораковую активность. Самым результативным оказалось производное мета-карборана, в котором атомы углерода не соседствуют, а разделены атомами бора. Мета-карборанкарбоновая кислота взаимодействует с оксидом дибутилолова, образуя соответствующий карборанкарбоксилат олова (рис.7). Это соединение в 30-40 раз (в зависимости от типа опухолевых клеток) эффективнее цисплатина или фторурацила, используемых в настоящее время для лечения меланомы, а также опухолей молочной железы или кишечника [13].
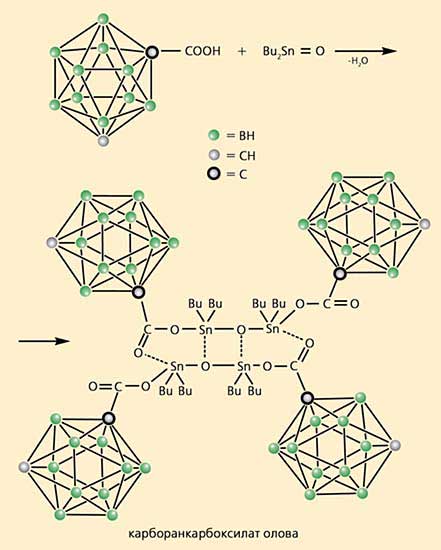
Рис.7. Схема получения препарата, содержащего олово и предназначенного для лечения онкологических заболеваний.
Совершенно очевидно, что конечный результат лечения онкологических заболеваний во многом зависит от диагностики: чем раньше выявлена болезнь, тем больше шансов на терапевтический успех. Современная медицина широко использует радиоизотопные диагностические методы. Их сущность заключается в том, что введенные в организм молекулы, меченные радионуклидами, хорошо “видны” с помощью детекторов радиоактивного излучения. Такая диагностика позволяет надежно определить функциональное состояние систем организма, а также выявить разного рода патологические очаги, в том числе и некоторые виды злокачественных новообразований. Из радиоактивных изотопов, используемых в настоящее время для получения диагностических радиоактивных препаратов, наиболее удобны с химической точки зрения радиоизотопы иода, в первую очередь 123I и 124I. К сожалению, связь С–I в органических соединениях недостаточно стабильна in vivo, и результаты диагностического исследования могут быть существенно искажены.
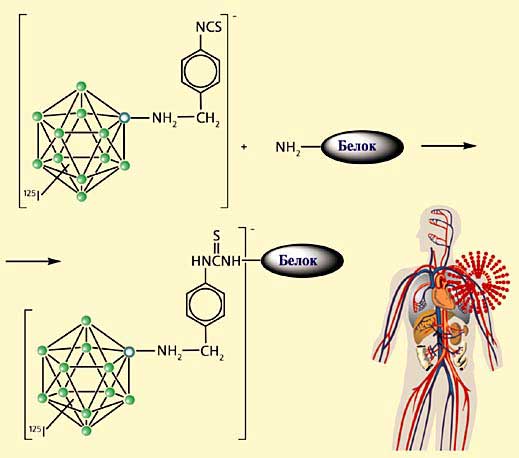
Рис.8. Схема взаимодействия рентгенодиагностического препарата и аминогруппы белка из опухолевых клеток.
Бороводородные каркасы помогают решить и диагностическую проблему (рис.8). Связь В–I заметно стабильнее в сравнении с C–I, благодаря чему получаются соединения с устойчивой меткой [14]. Радиоизотоп 125I был выбран потому, что по химическим свойствам он идентичен другим изотопам иода, но имеет достаточно удобный для экспериментальных исследований период полураспада - 60 дней. Чтобы обеспечить предпочтительное связывание с белковыми молекулами опухолевых клеток, мы использовали уже полученное нами аминопроизводное додекабората с изотиоцианатной группой NCS (см. рис.4). Она связывается с аминогруппами белков и обеспечивает таким образом избирательную доставку радиоактивной метки в клетки опухоли [15].
Нет сомнений, что химия бороводородов, богатая и интересная сама по себе, приложима не только к решению медицинских проблем. Например, натриевую соль кобальткарборана (см. рис.6) сейчас применяют для экстракции радиоактивных изотопов цезия и стронция из разных отходов ядерных производств, а карбораны, содержащие олово, мышьяк или сурьму, пригодны, как нам удалось показать, для использования в микроэлектронике. * * *
Потенциал каркасных бороводородов, скорее всего, еще не исчерпан, и будут найдены новые области, в которых эти соединения проявят свои уникальные возможности.
Работа выполнена при поддержке Российского фонда фундаментальных исследований. Проекты 99-03-33073 и 02-03-32192.
Литература
1. Locher G.L. // Am. J. Roentgenol. Radium Ther. 1936. V.36. P.1-13.
2. Hawthorne M.F. // Angew. Chem., Int. Ed. Engl. 1993. V.32. P.950-984.
3. Soloway A.H., Tjarks W., Barnum B.A. et al. // Chem. Rev. 1998. V.98. P.1515-1562.
4. Bregadze V.I. // Chem. Rev. 1992. V.92. P.209-223.
5. Valliant J.F., Guenther K.J., King A.S. et al. // Coord. Chem. Rev. 2002. V.232. P.173-230.
6. Boron Hydride Chemistry / Ed. E.L.Muetterties. N.Y., 1975.
7. Сиваев И.Б., Брегадзе В.И., Кузнецов Н.Т. // Изв. АН. Сер. хим. 2002. С.1256-1267.
8. Sivaev I.B., Semioshkin A.A., Brellochs B., Sjцberg S., Bregadze V.I. // Polyhedron. 2000. V.19. P.627-632.
9. Sivaev I.B., Bruskin A.B., Nesterov V.V., Antipin M.Yu., Bregadze V.I., Sjцberg S. // Inorg. Chem. 1999. V.38. P.5887-5893.
10. Khokhlov V.F., Kulakov V.N., Portnov A.A. et al. Preclinical NCT Studies at the IRT MEPhI Reactor // Research and Development in Neutron Capture Therapy. Bologna, 2002. P.769-773.
11. Sivaev I.B., Sjцberg S., Bregadze V.I. // J. Organomet. Chem. 2003. V.680. P.106-110.
12. Sivaev I.B., Starikova Z.A., Sjцberg S., Bregadze V.I. // J. Organomet. Chem. 2002. V.649. P.1-8.
13. Bregadze V.I., Glazun S.A., Petrovskii P.V. et al. // Appl. Organomet. Chem. 2003. V.17. P.453-457.
14. Hawthorne M.F., Maderna A. // Chem. Rev. 1999. V.99. P.3421-3434.
15. Tolmachev V., Bruskin A., Orlova A. et al. Radiohalogenated Polyhedral Borate Anions for the Use in Targeted Oncological Radionuclide Therapy: Review of the Latest Developments // Boron Chemistry at the Beginning of the 21th Century. Moscow, 2003. P.338-342.