© О.В. МихайловМноголикая изомерия
координационных соединенийО.В. Михайлов
Олег Васильевич Михайлов, доктор химических наук,
профессор Казанского государственного технологического университета.Глядя на мир, нельзя не удивляться!
Козьма Прутков. “Мысли и афоризмы”
Даже нескольких страниц любого школьного учебника по органической химии достаточно, чтобы обнаружить весьма любопытный факт: одному и тому же эмпирическому составу довольно часто отвечают как минимум два вещества, подчас с отличными друг от друга физико-химическими свойствами. Эти своеобразные двойники химического мира получили название изомеров (от греч. izos - равный, meros - мера). Примеров их множество, однако в сущности все двойники можно распределить на два типа: структурные изомеры, отличающиеся химическим строением, и пространственные, или стереоизомеры, - молекулы одного и того же химического строения, но с различной пространственной конфигурацией. К тому же органическая химия - это прежде всего, по образному выражению выдающегося популяризатора науки А.Азимова, - “мир углерода”. В таком мире главным и практически единственным строительным элементом кристаллической решетки служит тетраэдр. “Кирпичики” из других многогранников в строительстве этого мира практически не используются, что уже само по себе вносит весьма существенные ограничения и в проявлении изомерии.
Существует, однако, еще и представительный мир координационных соединений. Он находится на стыке современной неорганической и органической химии и сочетает в себе ряд особенностей как той, так и другой ветви современной химической науки. И стоит лишь немного заглянуть в этот мир, как заметишь, что проявления изомерии резко расширяются, возникают варианты, аналогов которым в “мире углерода” нет и быть не может. В свое время, кстати, именно изомерия сыграла роль своего рода третейского судьи, когда решался спор, правильна ли теория строения комплексов Бломстранда-Йёргенсена, формально использовавшая положения структурной теории Бутлерова, или координационная теория Вернера. Принята была последняя.
* * *
Прежде чем повести разговор об изомерии координационных (или, как их еще часто называют, комплексных) соединений, необходимо разобраться в том, что они вообще собой представляют. Первым это сделал швейцарский химик А.Вернер в 1893 г. (за что 20 лет спустя ему была присуждена одна из высших наград - Нобелевская премия). Основой его теоретических воззрений служило положение о координационном соединении как некоем многограннике, в геометрическом центре которого находится ион металла (называемый ныне комплексообразователем или центральным ионом), а в вершинах - ионы или нейтральные молекулы (по Вернеру - адденды, теперь - лиганды), соединенные с ним одной или бо?льшим числом химических связей, причем каждый из лигандов довольно жестко фиксирован в пространстве. Лиганд может образовать одну или несколько координационных связей с атомом металла, т.е. бывает моно-, би-, три- … и полидентатным (от лат. dentatus - зубчатый).
К монодентатным относятся ионы галогенов, H2O, H3N, пиридин,
к бидентатным - 1,2-этилендиамин (H2N-CH2-CH2-NH2), диметилглиоксим (H3C-C(=NOH)-C(=NOH)-CH3),
оксалат- (С2O4)2– и тиосульфат- (S2O3)2– анионы,
к тридентатным - диэтилентриамин (H2N-CH2-CH2-NH-CH2-CH2-NH2).
По введенной Вернером терминологии, лиганды составляют внутреннюю сферу комплекса, наличие которой - обязательное условие для причисления того или иного химического соединения к координационному “лику”. В большинстве случаев, однако, наряду с внутренней сферой у них есть еще и внешняя, в которой квартируют какие-либо противоионы. В частности, в хорошо знакомом многим координационном соединении - гексацианоферрате(III) калия K3[Fe(CN)6] (железосинеродистом калии, или феррицианиде калия по более древним номенклатурам), известном в народе как “красная кровяная соль”, монодентатные цианид-ионы и железо(III) составляют внутреннюю сферу, а ионы калия - внешнюю. Конечно, сказанным терминологические тонкости координационной химии далеко не исчерпываются (в этой связи уместно напомнить, что в настоящее время не существует общепринятого определения даже самого понятия “координационное соединение”). Однако пока мы ограничимся этим “прожиточным минимумом”, его вполне достаточно, чтобы рассмотреть известные к настоящему времени виды изомерии.
С некоторой долей условности их можно разделить по характерным признакам на три группы. Первую группу составят координационная и сольватная изомерии, ионизационная метамерия и координационная полимерия. В каждой из них изомеры отличаются химическим составом двух координационных сфер - либо внутренней и внешней, либо двух внутренних. Во второй группе окажутся лигандная, связевая, трансформационная и формальная изомерии. Здесь двойники различаются химическим составом лигандов лишь в одной (внутренней) координационной сфере. И наконец, геометрическая, оптическая, конформационная и аллогональная изомерии войдут в третью группу, где изомеры не сходны только геометрическим строением внутренней сферы.
В каждой из этих групп оказалось, по крайней мере на сегодня, по четыре вида изомерии. Автор, однако, ни в коей мере не претендует на исключительность такой классификации, тем более что есть еще внутримолекулярная хелатно-связевая и спиновая изомерии, которые в эту схему не вписываются. Рассказать подробно о каждой из почти полутора десятков разновидностей изомерных комплексов в данной статье невозможно и потому придется ограничиться лишь отдельными, наиболее яркими и интересными примерами из последней группы.
* * *
Пожалуй, наиболее простая изомерия - оптическая, та, которую обнаружил гениальный французский химик и биолог Л.Пастер еще в 1848 г. Изучая винную кислоту, он заметил, что это соединение кристаллизуется в двух асимметрических формах (так называемых энантиоморфных модификациях), внешне отличающихся друг от друга примерно так же, как левый ботинок от правого. Причина подобного явления коренится в способности целого ряда химических соединений образовывать структурные пары, которые соотносятся между собой как предмет и его зеркальное изображение. Подобные молекулы не имеют центра и плоскости симметрии. В мире координационных соединений едва ли не простейшим примером таковых могли бы быть тетраэдрические комплексы p- или d-элементов с четырьмя различными монодентатными лигандами. Но… такие комплексы до сих пор не известны.
Зато хорошо изучена оптическая изомерия для трис-комплексов [ML3]3+, в которых центральным атомом служит трехвалентный металл (хром, кобальт, родий или иридий), а лигандом - 1,2-этилендиамин.
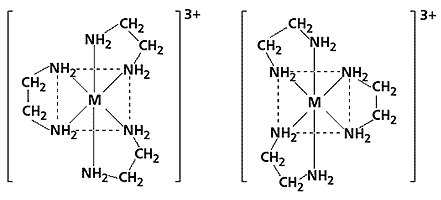
Пример оптических изомеров трис-комплекса. M: Cr(III), Co(III), Rh(III) или Ir(III).
Как нетрудно заметить, никакими поворотами не удастся совместить эти фигуры таким образом, чтобы положения всех одинаковых атомов полностью совпадали друг с другом.
Плоские же квадратные или ромбические комплексы не образуют подобных изомерных форм, так как обладают центром и (или) плоскостью симметрии (для некоторых, правда, известна оптическая изомерия, но она связана не с асимметрией всего соединения, а с оптической активностью его лигандов). Для плоских комплексов характерна геометрическая изомерия, обусловленная различием в ориентации донорных центров лиганда относительно центрального иона металла в координационном полиэдре. Простейший пример подобного рода - комплексы Pt(II) общего состава [Pt(NH3)2Cl2]. Изомер, в котором одинаковые лиганды (например Cl-) расположены по одному ребру квадрата, называется цис-формой, а если по диагонали, это транс-изомер (от лат. cis - вместе, trans - напротив). Сходная изомерия характерна и для комплексов состава [Pt(NH3)3Cl3]+, но здесь употребляется другая маркировка: конфигурация с тремя одинаковыми лигандами, которые находятся по одному меридиану, получила название mer-изомер, а другой, с лигандами, расположенными на лицевой стороне, - fac-изомер (от англ. meridional - меридиональный, facial - лицевой).
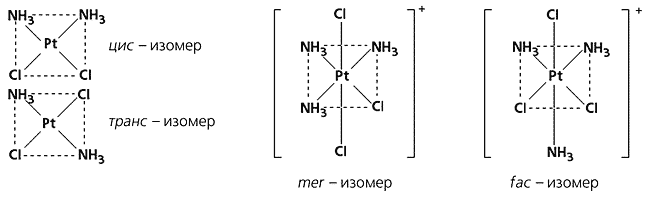
Геометрические изомеры.
Такие изомерные соединения, как правило, различаются цветом, формой кристаллов и отношением к определенным реагентам. Mer-[Pt(NH3)3Cl3]Cl окрашен в зеленовато-желтый цвет и его растворимость в воде составляет 5.64 масс. %, тогда как fac-[Pt(NH3)3Cl3]Cl - в бледно-желтый и растворим почти в четыре раза хуже (1.49 масс. %). При восстановлении, которое сопровождается удалением одной из координат октаэдра, первый образует безызомерный комплекс [Pt(NH3)3Cl]Cl, тогда как второй - цис-[Pt(NH3)2Cl2].
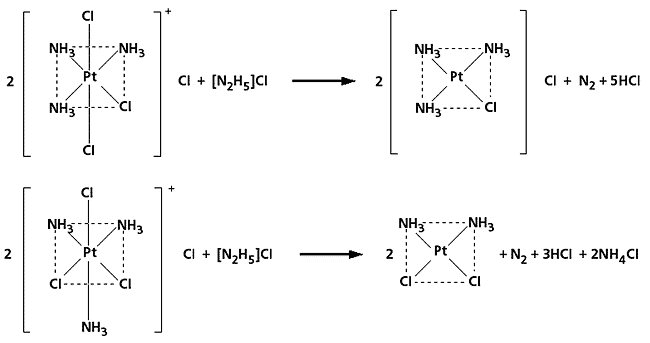
Схема восстановления двух геометрических изомеров.
Цис-транс-изомерия известна и для некоторых хелатных комплексов, например для хелатов двухвалентной платины c глицином (H2N-CH2-COOH). Однако образовать сразу два подобные изомера могут только довольно устойчивые комплексы, для лабильных же свойствен лишь изомер термодинамически более стабильный, т.е. с наименьшей свободной энергией. Поэтому, в частности, не существуют геометрические изомеры плоских квадратных комплексов Ni(II) и Au(III) с монодентатными лигандами. Какой из двух изомеров будет преобладать в растворе, где они находятся в таутомерном равновесии, зависит от растворителя. Если он полярный, равновесие смещается в сторону образования цис-формы, а если неполярный, - транс-изомера. Благодаря этому в неполярном диоксане можно, например, превратить цис-хелат меди(II) с 2-хлорбензгидразидом в соответствующий транс-комплекс.
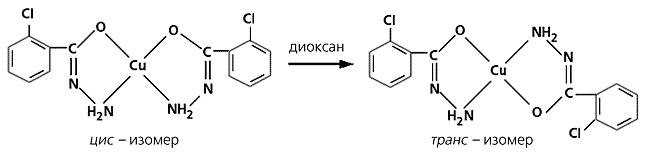
Схема трансформации одного изомера хелата меди в другой.
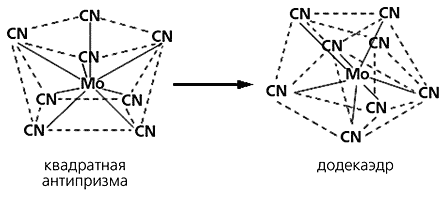
Комплексные соединения с координационными числами*, равными, скажем, четырем или восьми, могут существовать в виде двух или большем количестве разных многогранников, которые практически эквивалентны друг другу в энергетическом отношении. Эту разновидность изомерии, специфическую и весьма редкую, называют аллогональной (от греч. allos - различный, gonios - угол). Чаще всего один изомер имеет форму плоского квадрата, а другой - тетраэдра, как в координационном соединении [NiBr2{(C6H5)2(C2H5)P}2]. Его изомеры отличаются и цветом, и способностью намагничиваться. Кристаллы с плоскоквадратной ориентацией лигандов относительно атома никеля окрашены в темно-коричневый цвет и диамагнитны, а c тетраэдрической - темно-зеленые и парамагнитны. Известно соединение - Ni[(C6H5CH2)(C6H5)2P]2Br2, - кристаллы которого представляют собой своеобразный симбиоз молекул тетраэдрической и плоскоквадратной координаций. Помимо квадрата и тетраэдра возможны и другие варианты аллогональных изомеров - додекаэдр и квадратная антипризма, существующие в разных условиях и переходящие друг в друга.
Так, если комплекс с ионом [Mo(CN)8]4– находится в твердом состоянии, этот анион представляет собой додекаэдр, а если в водном растворе - квадратную антипризму.
Самая поразительная изомерия, припасенная на конец, - спиновая (она, как упоминалось, не вписывается ни в одну из трех групп изомерий). Спиновые изомеры - это координационные соединения, у которых в зависимости от температуры или каких-либо иных факторов изменяется лишь число неспаренных электронов, тогда как все остальное (стехиометрический состав, лиганды, их взаимное расположение в пространстве и даже геометрия координационного многогранника) одинаково. Примеры таких соединений - хелаты железа(III) c тио- или селеносемикарбазонами.
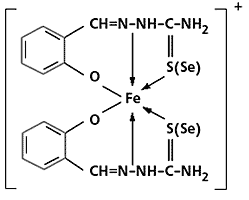
Хелат железа, способный образовывать спиновые изомеры.
Превращение аллогональных изомеров.Изомер, который содержит один неспаренный электрон, существует при низкой (<270 К) температуре, а второй, с пятью такими электронами, - при высокой. Окраской эти изомеры тоже отличаются друг от друга, и это вполне понятно, если учесть, что набор разрешенных электронных переходов, ответственных за цвет в видимой области спектра, у них резко различен. Аналогично ведут себя и дитиокарбаматные комплексы Fe(III) состава Fe(S2CNR2)3, где R - алкильный или арильный остатки. До сих пор ни у одного другого класса химических соединений чего-либо подобного не обнаружено.
* * *
Прагматичный читатель, каковых в наше рыночное время, наверное, куда больше, чем чистых философов, вправе задать вопрос: все это, может быть, и весьма важно для сугубо фундаментальной химической науки, но нельзя ли хоть что-то использовать для каких-либо прикладных целей? Конечно, значимые для практики достижения на данном поприще есть. В частности, существование изомерии приходится принимать во внимание при создании новых типов лекарственных препаратов на основе металлсодержащих соединений. Так, в 1969 г. было установлено, что упоминавшийся в статье цис-[Pt(NH3)2Cl2] обладает отчетливо выраженными противоопухолевыми свойствами, тогда как у его геометрического транс-изомера они напрочь отсутствуют. Еще более эффектным примером могут служить оптические изомеры комплекса [Ru(dipy)3]Cl2 (dipy - стилизованное обозначение 2,2'-дипиридила): один из них, правовращающий, - сильный мышиный яд, а другой, левовращающий, действует как противоядие.
Практическое приложение нашли созданные из бис(дитизонато)цинка(II) или бис(дитизонато)ртути(II) фотохромные полимерные пленки, которые при облучении светом меняют окраску за счет изомеризации координированного лиганда. Но все это - частности по сравнению с тем, что создали У.Ноулс, Р.Нойори и Б.Шарплесс. Они разработали методы получения оптически активных катализаторов для асимметричного гидрирования и окисления соединений разных классов, за что в 2001 г. и были удостоены Нобелевской премии (об этом см.: Лауреаты Нобелевской премии 2001 года // Природа. 2002. №1. С.69-72). Благодаря такому синтезу можно промышленно получать индивидуальные изомеры (а не их смесь) многих - и разнообразных - лекарственных препаратов, а также ароматизирующих веществ, подсластителей, инсектицидов и даже создавать новые материалы. Это поистине триумфальное шествие координационных изомеров!
А вообще надо помнить: ничего в принципе бесполезного фундаментальная наука (если это действительно фундаментальная наука, а не мимикрия под таковую) все же не создает, и задача ученых-технологов - суметь использовать ее достижения в той или иной отрасли практической деятельности человечества.
* * *
Так уж получилось, что первые строки статьи были написаны еще в 1980 г., а вот последняя точка поставлена более 20 лет спустя - под “занавес” 2001 г. И хотя за это время полку разновидностей изомерии как будто не прибыло, считать их перечень завершенным, видимо, еще рановато.