© М.Л. Рабинович, М.С. Мельник
Хвостатые ферменты
М.Л. Рабинович, М.С. Мельник
Михаил Лейбович Рабинович, доктор химических наук,
руководитель научно-учебного отдела биохимических проблем Института биохимии им. А.Н. Баха РАН,
профессор кафедры системной экологии Российского университета дружбы народов.Мария Степановна Мельник, кандидат химических наук, научный сотрудник того же института.
В истории борьбы США и Японии за господство на Тихом океане и в Юго-Восточной Азии в годы второй мировой войны помимо трагических моментов был и один курьезный эпизод, о котором не упоминают военные хроники. Дело в том, что поначалу американский десант нес весьма чувствительные потери от… микроскопической плесени. Во влажном и жарком климате эта удивительная зеленая плесень в считанные дни превращала в труху хлопчатобумажные, брезентовые тенты и палатки, оставляя элитные части армии под палящим солнцем и тропическими ливнями буквально в чем мать родила.
Положение казалось столь серьезным, что Министерство обороны США вынуждено было даже организовать специальный научный центр в Нейтике (штат Массачусетс). Именно там из разложившегося обмундирования выделили грибок, вырабатывающий необыкновенно агрессивные ферменты - целлюлазы, которые и разрушали целлюлозную основу ткани. Справедливости ради заметим, что на самом деле честь открытия расщепляющих целлюлозу микроорганизмов принадлежит нашему соотечественнику - русскому микробиологу В.Л.Омелянскому. Однако до работ американцев с помощью одних только ферментов (без микроорганизмов) удавалось разлагать лишь аморфные или растворимые производные целлюлозы, например карбоксиметилцеллюлозу (КМЦ), которая при заваривании образует студенистый клейстер (хорошо знакомый в быту обойный клей). Целлюлазы, разрезая длинные молекулы КМЦ, на глазах превращают студень в жиденький киселек. Ферменты же нового гриба этим не ограничивались. За пару дней при 30 - 50оС и рН 4 - 5 они почти без остатка разлагали хлопковое волокно. А ведь хлопковая целлюлоза (так называемая целлюлоза I) имеет настоящую кристаллическую укладку, стабилизированную межмолекулярными водородными связями. Она настолько плотная, что между соседними молекулами не проникают даже протоны. Недаром отдельные кристаллиты хлопкового волокна выдерживают кипячение в крепких растворах соляной кислоты!
Чтобы объяснить различия с другими микроорганизмами, Э.Рис и его коллеги из Нейтика предположили, что новый грибок, названный в честь своего первооткрывателя Trichoderma reesei, образует особый фермент (С1), который первым действует на хлопковое волокно и переводит молекулы целлюлозы в аморфное состояние, делая доступными для остальных целлюлаз (Cx) [1].
Такую целлюлозу действительно можно получить, если залить хлопок 85%-й фосфорной кислотой и дать постоять в холодильнике. Получится студень наподобие клея КМЦ. Если постепенно разбавлять его водой, начнут выпадать хлопья аморфной целлюлозы. Она легко гидролизуется целлюлазами, превращаясь в глюкозу и ее димер - целлобиозу, но во влажном виде аморфная целлюлоза постепенно снова кристаллизуется. Правда, образует она уже не целлюлозу I, а иную упорядоченную структуру. Однако суть от этого не меняется: в условиях, в которых действуют целлюлазы, аморфная целлюлоза менее устойчива, чем кристаллическая. Значит, чтобы катализировать процесс набухания кристаллической целлюлозы, фермент должен получать энергию извне. Но откуда?
Как открывали хвост
После войны интерес к ферментам Риса долго носил преимущественно академический характер. Ситуацию изменил энергетический кризис, выявивший полную зависимость современной западной цивилизации от экспорта нефти. Естественно, сразу обострился интерес к альтернативным источникам энергии. Вспомнили и про целлюлозу, ежегодное воспроизводство которой составляет 100 млрд тонн. Целлюлазы превращают ее в глюкозу - удобное сырье для получения этанола, рассматриваемого как моторное топливо будущего. Потому они и оказались в центре внимания.
На волне всеобщего интереса в 1974 г. по инициативе И.В.Березина начались исследования целлюлаз и на химическом факультете МГУ. И почти сразу были получены результаты, которые никак не укладывались в общепринятые представления.
В те годы еще не были расшифрованы пространственные структуры сотен белков, известные ныне. Поэтому структура целлюлаз, по аналогии с одним из первых изученных ферментов - лизоцимом из яичного белка, представлялась довольно просто: в виде компактной глобулы с углублением (активным центром), в котором происходит каталитический разрыв целлюлозной цепи. Лизоцим действительно похож на целлюлазы: он хорошо разжижает карбоксиметилхитин - близкий аналог КМЦ - и имеет такой же механизм катализа.
Лизоцим можно выделить из смеси белков куриного яйца аффинной хроматографией. Для этого смесь пропускают через колонку с хитином из панциря креветок. Лизоцим задерживается, а другие белки выходят. Затем колонку промывают раствором вещества (например, карбоксиметилхитина), которое проникает в активный центр адсорбированного на хитине лизоцима и вытесняет его в раствор. Так получают чистый фермент уже без примесей других яичных белков.
Мы тоже попытались выделить целлюлазы аффинной хроматографией. Пропустили раствор образуемых грибом белков через колонку с целлюлозой. И сразу были озадачены: вместе с сопутствующими белками вышло и некоторое количество целлюлаз. Те же, что задержались, повели себя не менее неожиданно - никак не хотели покидать колонку, промытую концентрированным раствором КМЦ. Вязкость выходящего из колонки раствора КМЦ при этом была почти как у воды, значит, молекулы КМЦ, действительно, попадали в активный центр застрявших целлюлаз и там расщеплялись. Стало ясно, что ферменты цепляются за целлюлозу не активным центром, расщепляющим КМЦ, а чем-то иным, с чем КМЦ не взаимодействует. Очевидно, этот дополнительный центр связывания узнает не отдельные молекулы, а поверхность целлюлозы как целое.
Микрофотография поверхности целлюлозы I [12] и схема ее строения [9]. Каждое целлобиозное звено (одно из них выделено цветом) образует четыре водородные связи с соседними молекулами одного слоя. Внутримолекулярные водородные связи стабилизируют каждую цепь, межмолекулярные - прочно сшивают между собой соседние цепи. Целлюлозная молекула нижнего слоя показана черным цветом.Одновременно с нами публиковали свои данные японские исследователи, которые изучали глюкоамилазу (фермент гриба Aspergillus awamori, превращающий крахмал в глюкозу), и обнаружили, что и этот грибной фермент прикрепляется к гранулам нерастворимого крахмала вовсе не активным центром, а другим участком полипептидной цепи. С помощью протеазы - субтилизина - удалось вырезать этот участок и проанализировать. Выяснилось, что он содержит 30 - 40 аминокислотных остатков и до 50% углеводов по массе. Укороченная глюкоамилаза переставала расщеплять гранулы сырого крахмала, но продолжала хорошо переваривать набухший крахмальный клейстер. Впоследствии было установлено, что в среде роста гриба содержится как полноразмерный фермент, так и его усеченные формы [2].Среди целлюлаз Trichoderma reesei также обнаружены ферменты, которые различались почти на два порядка по эффективности связывания с поверхностью нерастворимой целлюлозы, хотя были одинаково активны по отношению к КМЦ. Это позволило заключить, что не у всех целлюлаз есть обособленный участок, позволяющий им связываться с нерастворимой целлюлозой. Вот тогда и вспомнили о С1-Сх-гипотезе американских исследователей и стали искать взаимосвязь между содержанием прочно связывающихся целлюлаз у разных грибов и их способностью разрушать кристаллическую целлюлозу. Такая корреляция вскоре была обнаружена, при этом оказалось, что дело вовсе не в концентрировании фермента на поверхности целлюлозы: даже 100-кратное увеличение количества плохо связывающихся ферментов не приводило к полному разложению кристаллической целлюлозы, зато с аморфной целлюлозой они справлялись очень эффективно.
Мы предположили, что фрагмент белковой молекулы специфически адсорбируется на поверхности целлюлозы и расклинивает пучки ее микрофибрилл, тем самым помогая проникать молекулам воды, в результате целлюлоза набухает, что в значительной мере облегчает работу ферментам-гидролазам [3]. Такое явление (адсорбционное понижение прочности, или эффект П.А.Ребиндера) широко известно в физико-химической механике. Однако, в отличие от Риса, мы считали, что дело не в специфическом типе ферментативного катализа, а в механическом расслоении целлюлозы на отдельные фибриллы, которые стабилизируются прочно адсорбированными белками, работающими как высокоспецифичные поверхностно-активные вещества. Для проверки своей гипотезы мы стали специально подавлять каталитическое действие прочно связывающихся ферментов снижением температуры и добавлением ингибиторов, однако и в этих условиях обработанная ферментами бумага при сильном встряхивании рассыпалась на отдельные волокна значительно легче, чем без них. Забегая вперед, заметим, что спустя почти 10 лет, в начале 90-х годов, к тому же выводу пришли и канадские специалисты из Ванкувера. Они показали, что выделенный ими сорбционный центр бактериальной целлюлазы хорошо диспергирует кристаллическую целлюлозу и помогает каталитической части фермента расщеплять ее даже в усеченном виде.
В 70-е же годы стало ясно, что белок, который Рис принимал за С1-фермент, в действительности обладает очень слабой, но вполне измеримой способностью к гидролизу целлюлозных молекул с образованием целлобиозы. Поэтому его переименовали в целлобиогидролазу. Так как Trichoderma reesei образует еще одну целлобиогидролазу, их обозначили соответственно как целлобиогидролазы I и II. Помимо них у гриба обнаружили от четырех до шести типов эндоглюканаз - Сх-ферментов, отвечающих за разжижение растворов КМЦ [4].
Чтобы выяснить, какие именно ферменты обладают центром прочной сорбции, из набора белков, вырабатываемых грибом, мы сначала отобрали те, которые прилипают к целлюлозе. Полученную целлюлозную пасту нанесли на поверхность пластины геля для изоэлектрофокусирования. Под действием электрического поля ферменты отрывались от неподвижных частиц целлюлозы и выстраивались в геле в соответствии со своими изоэлектрическими точками. Затем их окрасили специфическими красителями и сравнили полученную картину с результатами гельэлектрофореза исходного набора белков.
Выяснилось, что на целлюлозе прочно адсорбируются целлобиогидролазы I и II и эндоглюканазы I и II, но не эндоглюканаза III. Наиболее специфичным оказалось именно связывание целлобиогидролазы I - C1-фермента Риса. На основе полученных данных и был сформулирован новый механизм разложения кристаллической целлюлозы. Слабо сорбирующимся эндоглюканазам (усеченным формам эндоглюканаз I и II, а также эндоглюканазе III) отводилась в нем роль ферментов, расщепляющих внешние аморфные области целлюлозы и открывающих внутренние дефекты. Туда проникают прочно сорбирующиеся целлобиогидролазы и эндоглюканазы, расклинивающие пучки на отдельные фибриллы, которые постепенно разрушаются с разных концов целлюлозных молекул.
Как только в 1983 г. в журнале «Biotechnology» была опубликована полная аминокислотная последовательность целлобиогидролазы I [5], наше внимание сразу привлек богатый оксиаминокислотами фрагмент, который мог бы служить местом прикрепления углеводов и сорбционным центром, подобным имеющемуся у глюкоамилазы. Такой фрагмент - 20-членный пептид, в котором, чередуясь с остатками пролина, соседствуют 14 остатков треонина и серина, - находится вблизи С-конца молекулы. Нуклеотидная последовательность, кодирующая С-концевой участок молекулы целлобиогидролазы, отделена от остальной части гена незначащей вставкой (интроном). Все это позволило заключить, что центр связывания у целлюлаз - самостоятельная структура, которая работает подобно якорю, хвосту или клину, а не как капкан, захватывающий молекулу целлюлозы. К сожалению, рукопись заказанного в 1983 г. на эту тему обзора пролежала в издательстве «Наука» четыре года; к тому же научный редактор убрал в окончательном варианте слишком образные сравнения. А жаль. Впрочем, отличить предвидение от фантазии действительно нелегко.
Структура сорбционного центра (целлюлозосвязывающего домена) целлобиогидролазы I [11]. «Лапы» - это три остатка тирозина, непосредственно взаимодействующие с гидрофобными частями остатков глюкозы на поверхности целлюлозы. Стрелками обозначены бета-тяжи - элементы вторичной структуры белка.Предсказанная конструкция сорбционного центра давала возможность конструировать самые разные гибридные белки: хвостатые ферменты, антитела, токсины, белковые ингибиторы. На их основе можно было бы создавать биоактивные ткани и перевязочные материалы, специфические тест-системы на полосках бумаги, наконец, фармпрепараты пролонгированного действия на микрокристаллической целлюлозе. Однако отделить от целлобиогидролазы I участок связывания на целлюлозе и определить его последовательность нам не удалось, хотя были испытаны разные протеазы: субтилизин, трипсин, химотрипсин.Лишь через три года с этой задачей справились в совместной работе специалисты из Бельгии и Швеции. Для этого они использовали протеазу иного типа - папаин. Полученные ими данные в основном подтвердили наши предположения, но не полностью. Богатый пролином и треонином фрагмент, принятый нами за сорбционный центр, оказался линкером - связкой между двумя частями молекулы целлобиогидролазы I. Именно там и действовал папаин: он вызывал появление в растворе каталитической части фермента, которую легко увидеть по катализируемой ею специфической реакции с флуоресцентным производным целлобиозы. Хвост же остается на поверхности, откуда его можно смыть детергентом (проще говоря, стиральным порошком). Он оказался 35-членным пептидом, расположенным на С-конце молекулы фермента сразу вслед за линкером. Связывание его с целлюлозой обеспечивали три остатка тирозина [6].
В 1989 г. финские, шведские и американские исследователи совместными усилиями расшифровали пространственную структуру сорбционного центра (или субстратсвязывающего модуля, как теперь говорят) целлобиогидролазы I. Он, действительно, имеет клиновидную форму с двумя плоскими гранями - гидрофильной и гидрофобной, обращенной к поверхности целлюлозы. Линкер, связывающий его с каталитической частью, имеет гибкую (шарнирную) и жесткую (гликозилированную) части [7].
Интересно, что хвостовая часть грибных целлюлаз по своей форме очень напоминает совсем, казалось бы, далекий белок - низкомолекулярный ингибитор протеаз из картофеля. Трудно сказать, случайное ли это совпадение. Однако заметим, что ингибиторы протеаз иногда тоже выполняют функции хвоста у ферментов, которые они ингибируют. Так построена, например, панкреатическая прокарбоксипептидаза А.
Фермент образуется в неактивном состоянии (как змея, кусающая свой хвост), когда ингибитор «затыкает» активный центр фермента, не давая ему начать работу раньше времени [8]. Расщепление линкера протеазой ведет к отделению хвостового фрагмента и активации фермента.
Примеры хвостатых ферментов [8, 13]. Слева. Активный центр целлобиогидролазы II охватывает фрагмент расщепляемой целлюлозной молекулы, как клещами. Небольшой сорбционный центр прикреплен к основной части молекулы через длинный соединительный пептид - линкер.
Справа. Хвостовой домен прокарбоксипептидазы (выделен голубым цветом) закрывает активный центр фермента (гибкие неструктурированные петли в верхней части каталитического домена, показанного красным цветом). После протеолитической активации (расщепления связующего линкера в области, отмеченной синей стрелкой) хвостовая часть молекулы отделяется и фермент становится активным. Зеленый шарик - ион металла в активном центре, зеленые ломанные «антенны» вблизи сайта расщепления - олигосахариды, ковалентно связанные с белком. Для линкеров, соединяющих разные модули в белках, такое явление (гликозилирование) весьма характерно. Полагают, что это защищает линкеры от «несанкционированного» расщепления неспецифическими «чужими» протеазами.
Сходство пространственных структур белковых ингибиторов ферментов и субстратсвязывающих модулей целлюлаз натолкнуло на мысль о создании гибридных модулей, обладающих и теми и другими свойствами. В связывание с целлюлозой вовлечены ароматические остатки, лежащие в бета-тяжах, а в связывание с протеазами - остатки в области гибкой петли. Таким образом, можно пытаться создать химерные белковые ингибиторы малого размера, прочно адсорбирующиеся на целлюлозных подложках. Такие ингибиторы могут найти применение в медицине и фармации как препараты пролонгированного действия.Ползают ли ферменты?
И все же, как работают на гладкой поверхности кристаллической целлюлозы хвостатые ферменты, подобные целлобиогидролазе I? Этот вопрос вызывает бурные дискуссии уже многие годы. Мысль о том, что «неживая» молекула фермента перемещается по поверхности, кажется фантастической.
Однако можно весьма просто показать, что молекулы хвостатых ферментов способны, например, прыгать от одной частицы целлюлозы к другой. Для этого удобно использовать окрашенную целлюлозу. По химической природе это та же крашеная хлопковая ткань, только измельченная в пыль. Ферменты срезают с ее поверхности короткие «ворсинки» - олигосахариды, на которых держится краситель: происходит, проще говоря, линька. Это качество целлюлаз широко используют при производстве вылинявшей джинсовой ткани, «варенки». Раньше лишнюю краску удаляли в стиральных машинах пемзой. Теперь используют биоабразивы - целлюлазы.
Так вот, если посадить хвостатые целлюлазы сначала на частицы обычной микрокристаллической целлюлозы, а затем добавить порошок окрашенной целлюлозы, то сначала ничего заметить не удается. Но спустя какое-то время (от 15 - 20 мин до полутора часов, в зависимости от условий) окрашенная целлюлоза начинает линять и в растворе появляются молекулы красителя. Поскольку частицы белой целлюлозы за такой срок не успевают полностью перевариться, это значит, что часть хвостатых молекул «перепрыгнула» с белых частиц на окрашенные и начала там работать.
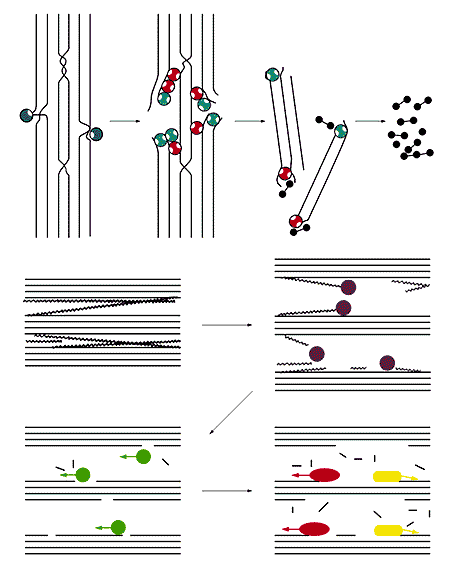
Механизм ферментативного гидролиза кристаллической целлюлозы.Вверху - по представлениям 1984 г. Сначала слабо сорбирующиеся на целлюлозе эндоглюканазы (синие кружки с одним сегментом - активным центром) атакуют внешне неупорядоченные участки целюлозной фибриллы. В образовавшиеся дефекты проникают прочно связывающиеся эндоглюканазы (розовые кружки с двумя сегментами - активным и сорбционным центрами) и целлобиогидролазы (зеленые кружки также с двумя сегментами), которые расклинивают их и обнажают внутренние неупорядоченные области. Образуются короткие микрокристаллиты, которые расщепляются ферментами с концов (показано действие разных типов ферментов с разных концов кристаллита). В результате образуются молекулы целлобиозы («гантельки»), а также небольшое количество глюкозы и трисахарида - целлотриозы [3].Конечно же, не скука заставляет целлюлазы покидать «обжитую» частицу целлюлозы ради новой. «Приказывает» им равномерно заселять всю доступную поверхность Второй закон термодинамики, разрешающий в изолированных системах наиболее вероятные процессы. Другое дело, что перераспределение может занимать разное время, в зависимости от того, насколько прочно прикрепляются молекулы к поверхности. Например, чем дольше целлюлазы сидят на белой целлюлозе, тем труднее перескакивают потом на окрашенную. Видимо, «осваивают» дефекты структуры, откуда труднее потом выбраться [9].Внизу - по современным представлениям, разложение пучков целлюлозных фибрилл начинается с удаления связующих неупорядоченных молекул слабо сорбирующимися эндоглюканазами III (фиолетовые кружки), лишенными сорбционных доменов. Далее отдельные фибриллы разрушаются прочно сорбирующимися «хвостатыми» эндоглюканазами I и II (зеленые кружки), которые образуют на поверхности кристаллитов разрывы целлюлозных молекул. Эти разрывы расширяются в разные стороны «хвостатыми» целлобиогидролазами I и II (красные и желтые эллипсы).
В результате образуются молекулы целлобиозы, глюкозы и целлотриозы [14].
Много ли успевают сделать ферменты, пока сидят в одном месте? В растворе за полчаса-час каждая молекула разрезает тысячи молекул КМЦ. На поверхности число разрывов во много раз меньше. Часть времени адсорбированные целлюлазы «сидят без дела», и их активные центры могут в это время расщеплять проплывающие мимо молекулы КМЦ. Могут они и захватывать из раствора флуоресцирующие производные глюкозы, пришивая их к поверхности. Эта реакция называется трансферазной активностью. Впрочем, заметить ее можно лишь с помощью специальной техники [9].
Но как же все-таки плотно упакованная цепь целлюлозы попадает в активный центр целлобиогидролаз? Ведь для того чтобы отщепить молекулу целлобиозы, ферменту необходимо оторвать от поверхности конец цепи длиной до 10 глюкозных остатков. Значит, даже у цепей, лежащих на краю поверхности микрокристаллита, нужно разорвать по паре водородных связей на каждое целлобиозное звено. Откуда же берется для этого столько энергии?
По одной из гипотез, целлобиогидролаза использует энергию, выделяющуюся при разрыве гликозидной связи, аналогично тому, как АТФаза миозиновой головки использует энергию гидролиза АТФ для мышечного сокращения [10]. Пока, однако, доказательств этого не получено.
Мы рассматриваем и другой возможный источник энергии. По нашим данным, каталитическая часть фермента обладает очень высоким сродством к изолированному фрагменту целлюлозной цепи длиной не менее четырех глюкозных остатков. В свою очередь сорбционный центр обладает столь же высоким сродством к поверхности целлюлозы. Но целый фермент связывается с целлюлозой лишь чуть-чуть прочнее, чем каждая из его частей. Значит, они связываются или поочередно, или не полностью. Этот вывод можно подкрепить рядом доводов. Во-первых, слишком прочное связывание затрудняло бы высвобождение фермента для нового каталитического процесса. Во-вторых, при ограниченной длине линкера каталитическая и сорбционная части должны мешать друг другу связываться в полную силу, так как первая нуждается в гидратированном конце изолированной молекулы целлюлозы, а вторая в гидрофобных участках гладкой поверхности. В третьих, как уже говорилось, часть сидящих на поверхности молекул имеет не до конца заполненный активный центр. Таким образом, у фермента, видимо, есть резерв энергии связывания: разность между оптимальным и частично ослабленным связыванием обеих частей. Передаточным механизмом, преобразующим этот резерв в энергию, необходимую для разрыва водородных связей вокруг расщепляемой молекулы целлюлозы, может служить упругая деформация жесткой гликозилированной части линкера, не позволяющей обоим доменам одновременно реализовать оптимальное связывание. Ее можно уподобить упругому удилищу, которое постепенно вытягивает «рыбу» (конец целлюлозной молекулы) из «воды» (сетки водородных связей) на «крючке» (каталитическом домене). В этом сравнении «леска» - это гибкая шарнирная часть линкера, а «рыболов» - сорбционный домен [11].
Структура каталитической части целлобиогидролазы I. Показана укладка фрагмента молекулы целлюлозы в активном центре (PDB код 7CEL). Чтобы такой фрагмент попал в активный центр, его нужно освободить из окружения соседних молекул - разорвать десяток-другой водородных связей.В целлюлазном катализе известно явление, когда сидящий на одном месте «рыболов» вытягивает всю «рыбу», до которой дотянется «леска»-линкер, и остается затем без работы. Его называют непродуктивным связыванием, или обратимой инактивацией фермента на поверхности целлюлозы. Чтобы заставить фермент снова работать, можно либо добавить свежей целлюлозы, переманив «рыболова» на новое место, либо срезать «леску» специальной протеазой, как иногда поступает гриб - хозяин фермента. Освобожденный каталитический домен может по крайней мере расщеплять аморфную целлюлозу там, где он до нее не дотянулся бы, оставаясь привязанным к сорбционному домену.Однако возможен и другой поворот: «рыба» вместе с «крючком» в какой-то момент перетянет «рыболова» и оторвет его от поверхности. Жесткая гликозилированная часть линкера работает при этом как трамплин или качели-перевески. Последовательность событий при этом может быть такой. Сначала связывается сорбционный центр, а каталитический остается свободен. Затем происходит медленный переход в состояние, в котором с целлюлозой связаны оба центра, но лишь частично. Далее снова медленный переход, когда сорбционный центр освобождается полностью, а каталитический полностью заполняется. И лишь затем происходит быстрая каталитическая реакция с выбросом растворимого продукта, сопровождаемая освобождением каталитического центра и связыванием сорбционного. Потом цикл повторяется.
Не правда ли, похоже на гусеницу-землемера, поочередно подымающую то голову, то хвост при перемещении по поверхности? Или на улитку, несущую за собой свою раковину - каталитический домен. В самом деле, вместо дискретных стадий может происходить непрерывное «перетекание» ферментного комплекса по пути реакции от начального состояния к конечному, как у гусеницы со множеством ножек.
Разумеется, этот гипотетический механизм, названный нами катерпиллерным катализом, требует детальной экспериментальной проверки. Но в этом-то и состоит вся прелесть научного творчества.
Работа выполнена при поддержке Российского фонда фундаментальных исследований.
Проекты 02-04-49033 и 02-04-48286.Литература
1. Reese E.T. Enzyme systems for cellulose. Biotechnol Bioeng Symp. 1975. V.5. P.77 - 80.
2. Hayashida S. // Agric. Biol. Chem. 1975. №39. P.2093 - 2099.
3. Rabinovich M.L. // Materials of Soviet-Finland Seminar on Bioconversion of Plant Raw Materials by Microorganisms. Institute of Biochemistry and Physiology of Microorganisms. Pushchino, 1984. Р.31 - 48.
4. Wood T.M., McCrae S.I. // Biochem. J. 1978. V.171. №1. P.61 - 72.
5. Teeri T.T., Salovuori I., Knowles J. // Biotechnology. 1983. V.1. P.670 - 673.
6. Tilbeurgh H. van, Tomme P., Claeyssens M. et al. // FEBS Lett. 1986. V.204. P.223 - 227.
7. Kraulis P.J., Clore G.M., Nilges M. et al. // Biochemistry. 1989. V.28. P.7241 - 7257.
8. Vendrell J. et al. // Biophys. Biochim. Acta. 2000. №1477. Р.284 - 298.
9. Рабинович М.Л., Болобова А.В., Кондращенко В.И. Теоретические основы биотехнологии древесных композитов. Древесина и разрушающие ее грибы. М., 2001.
10. Sinnott M.L. // Biochem. Soc. Trans. 1998. V26. №2. P.160 - 164.
11. Рабинович М.Л., Мельник М.С., Болобова А.В. // Биохимия. 2002. Т.67. №8. С.1026 - 1050.
12. Baker A.A. et al. // Biophys. J. 2000. V.79. №2. Р.1139 - 1145.
13. Suominen P., Reinikainen T. Trichoderma reesei cellulases and other hydrolases. // Foundation for Biochemical and Industrial fermentation Research. 1993. V.8.
14. Henriksson G. et al. // Eur. J. Biochem. 1999. №259. Р.88 - 95.
Апрель 2003