№5, 2004 г.
© Бейер Т.В., Свежова Н.В.
Принцип троянского
коня,
или
Как протозойный патоген проникает в живую клетку
Т.В. Бейер, Н.В. Свежова
Тамара Владимировна Бейер, д.б.н., проф., в.н.с.,
Надежда Викторовна Свежова, к.б.н.,
лаборатории цитологии одноклеточных организмов Института цитологии РАН.
научный сотрудник той же лаборатории.
Обеденный перерыв подходил к концу, когда неожиданно заговорили о находчивости греческих военачальников, придумавших деревянного коня, с помощью которого данайцы проникли в Трою. “И все же обман - классная вещь! - заметил наш молодой сотрудник. - Ведь и микроорганизмы смогли перейти к внутриклеточному паразитизму лишь благодаря тому, что “научились” попадать в живую клетку, прикинувшись пищевыми частицами, т.е. подобно данайцам с их известным троянским конем…” Смех смехом, а молодой коллега был недалек от истины.
Наша небольшая научная группа уже довольно давно интересуется выяснением путей и способов проникновения в клетку чужеродных организмов, в частности внутриклеточных паразитических простейших - кокцидий (отряд Coccidia, класс Sporozoa). Многие из них вызывают тяжелые инфекционные заболевания человека и животных (токсоплазмоз, криптоспоридиоз, саркоцистоз, изоспороз, эймериоз и др.); этим заболеваниям подвержены в первую очередь дети и молодые животные. Некоторые кокцидии (Toxoplasma gondii, Cryptosporidium parvum и др.) считаются условно-патогенными организмами, а вызываемые ими инфекции - оппортунистическими (от англ. opportunity - возможность). Проявляются они у заразившихся людей спустя годы при нарушении иммунной системы (например, при инфицировании вирусом иммунодефицита человека). Есть данные, что антитела к T.gondii имеются почти у трети населения земного шара [1], а у 40% больных параллельно со СПИДом развивается токсоплазмозный энцефалит, при этом уровень смертности среди таких людей достигает 10-30% [2].
Ранее нами была высказана гипотеза, которая впоследствии подтвердилась, согласно которой в жизненном цикле оппортунистического патогена есть латентные (скрытые) стадии, позволяющие ему выживать в организме хозяина с нормальной иммунной системой в течение долгого времени. Такие патогены, как T.gondii и Isospora belli способны длительно сохраняться внутри защитных образований (цист) в тканях головного мозга или мышц, куда почти не проникают антитела. Однако в условиях иммунодефицита, когда в крови хозяина количество Т4-лимфоцитов резко снижается, ранее покоившийся паразит получает возможность бесконтрольно размножаться [3]. Таким образом, человек может быть инфицирован T.gondii в детстве и всю жизнь словно сидит на неразорвавшейся бомбе, а спустя многие годы при наступлении иммунодефицита вдруг серьезно заболевает и даже может погибнуть от патогена, давно покоившегося в его организме. Ясно, что для успешной борьбы со столь опасным недугом необходимо понять суть механизмов клеточного взаимодействия двух эукариотных систем - одноклеточного паразита и заключающей его клетки многоклеточного организма.
Паразитизм - широко распространенное биологическое явление, при котором один организм (паразит) живет и питается за счет другого (хозяина). Особенность кокцидий состоит в том, что все кардинальные процессы их жизнедеятельности совершаются только внутри живой клетки, которая представляет собой уникальное, хорошо защищенное образование. Снаружи клетка покрыта плазматической мембраной со встроенными в нее многочисленными рецепторами, способными распознавать не только специфические группировки чужеродных молекул, но и целые клетки, и сразу передавать внутрь полученные сигналы. Через такой плотный фильтр, каковым, например, является наружный покров энтероцита кишечника, не могут пройти даже бактерии, не говоря уже о значительно более крупных паразитических простейших [4]. * * *
К важнейшим внутриклеточным защитным механизмам относятся окислительный взрыв и лизосомальное переваривание. В первом случае микроорганизмы подвергаются губительному действию потенциально токсичных кислородных метаболитов (супероксидов, перекиси водорода, гидроксильных радикалов); во втором - они гидролизуются содержащимися в лизосомах ферментами [5, 6]. Но еще раньше, до проникновения в клетку, во внеклеточном пространстве паразит сталкивается с уникальной защитной системой в виде каскада комплемента, которая дополняет и усиливает действие антител. Эта система служит важным звеном антипаразитарной защиты в организме хозяина [7].
Таким образом, живая клетка подобна неприступной крепости, вход в которую хорошо защищен от неприятеля со всех сторон. И для того, чтобы войти в клетку, паразит в ходе эволюции должен был научиться избегать действия защитных сил хозяина, т.е. в какой-то степени уметь ее обмануть, как это сделали когда-то данайцы, спрятавшись в чреве деревянного коня.
Любая клетка живет за счет поступления в нее питательных веществ, и чужеродный организм может в нее попасть в обличье пищевой частицы. Проникновение пищевой частицы начинается с вдавливания внутрь (инвагинирования) наружной плазматической мембраны, которая постепенно обволакивает эту частицу, пока та не оказывается внутри мембранного пузырька (эндосомы). И с этого момента захваченная частица обречена на гибель. В мембране пузырька начинает действовать протонный насос, что приводит к закислению внутренней среды пузырька до рН 3.5-5.0 (лизосомальные ферменты активны только в кислой среде). Затем мембрана эндосомы сливается с мембранами лизосом, в результате чего ферменты и пищевые частицы оказываются в одном пузырьке - вторичной лизосоме (фаголизосоме), где пищевые частицы перевариваются.
Проникновение микроорганизмов под видом пищевой частицы (по принципу троянского коня) оказывается наиболее щадящим способом внедрения в живую клетку. Важно, что при этом не происходит разрыва клеточной мембраны, благодаря чему зараженная клетка продолжает нормально функционировать, обеспечивая оптимальные условия для роста и размножения паразита. Такой путь вхождения в клетку фактически повторяет (рекапитулирует) предковый признак клеток позвоночных - захват пищевых частиц и их внутриклеточное переваривание. Этот признак сохранился до наших дней только в клетках иммунной системы позвоночных - в макрофагах, нейтрофилах, эозинофилах.
Подобно пищевым частицам, многие микроорганизмы начинают проникновение в клетку с инвагинирования ее плазматической мембраны, и по мере продвижения внутрь покрываются этой мембраной до тех пор, пока не окажутся в пространстве мембранного пузырька, или паразитофорной вакуоли.
Казалось бы, “плененный” паразит подобно пищевой частице должен был бы стать жертвой лизосомального переваривания. Однако этого не происходит, так как еще в ходе проникновения в клетку и по его завершении зоиты кокцидий укрепляют стенку завоеванного жилища, т.е. паразитофорной вакуоли. Качественный и количественный состав белков и липидов мембраны этой вакуоли претерпевает значительные изменения, включающие, например, резкое сокращение числа интегральных белковых молекул - внутримембранных частиц, или избирательное удаление некоторых белков плазматической мембраны (FcR, CD44), участвующих в презентации антигенов. В результате этого измененная мембрана становится неузнаваемой для лизосом, а паразит, заключенный внутри паразитофорной вакуоли, - недосягаемым для гидролитических ферментов [8].
В последнее время было выявлено огромное разнообразие паразитофорных вакуолей, что можно объяснить существующими различиями в стратегии разных паразитических простейших (микроспоридий, жгутиконосцев, споровиков), используемой ими при проникновении в клетку и в ходе дальнейшего внутриклеточного развития. Но что интересно – проникновение по принципу “троянского коня” характерно только для споровиков [9, 10]. К сожалению, структура паразитофорных вакуолей у разных кокцидий изучена пока недостаточно полно для того, чтобы можно было сформулировать общие закономерности формирования паразитофорных вакуолей, сложившиеся в ходе эволюции кокцидий в целом. Наилучшие результаты, с применением современных методов биохимии и молекулярной биологии, были получены для цистообразующих кокцидий и, прежде всего T.gondii [11, 12].Зоиты кокцидий (правая колонка) проникают в живую клетку подобно пищевым частицам (средняя колонка), что очень напоминает знаменитую историю о троянском коне. Оказавшись в клетке, зоиты кокцидий постепенно меняют химический состав инвагинированной плазматической мембраны, что делает ее неузнаваемой для лизосом клетки хозяина. Пищевые частицы, проникнув в клетку, как известно, подвергаются гидролизу лизосомальными ферментами. 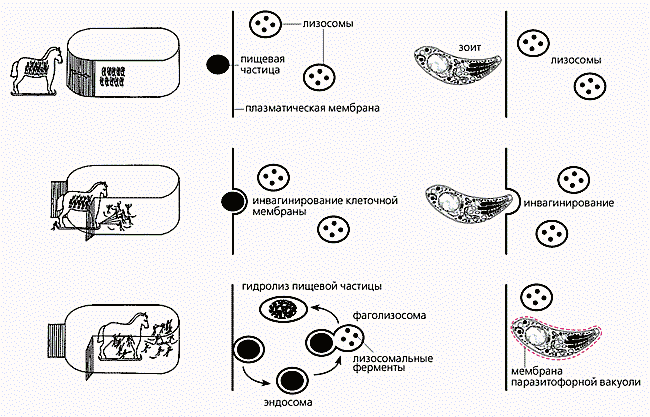
Схемы, отражающие мифологическое событие и биологические явления.
Токсоплазма развивается при участии двух хозяев - промежуточного и окончательного; такой тип жизненного цикла называется гетероксенным. Помимо человека, промежуточными хозяевами для T.gondii служат еще 350 видов млекопитающих, птиц и рептилий, тогда как окончательными хозяевами - лишь представители семейства кошачьих [1].
В промежуточном хозяине паразит размножается только бесполым путем, который включает две стадии развития: тахизоиты, которые быстро размножаются (пролиферируют) практически во всех типах клеток и тканей, и медленно пролиферирующие брадизоиты, развивающиеся внутри тканевых цист в головном мозге или мышцах, где, напомним, иммунный надзор слабее. Важно подчеркнуть, что токсоплазма никогда не развивается в клетках эпителия кишечника (энтероцитах) промежуточного хозяина.
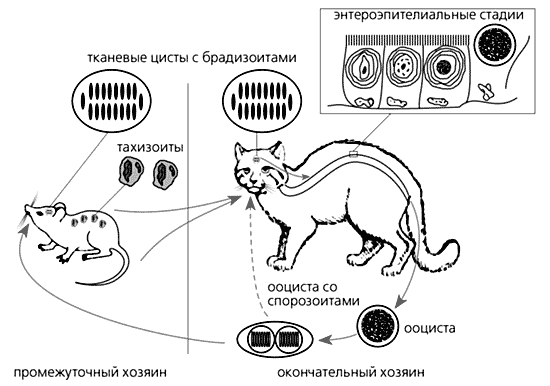
Схема жизненного цикла Toxoplasma gondii.
В отличие от промежуточного, в окончательном хозяине этот патоген паразитирует преимущественно в клетках кишечного эпителия, где бесполое размножение сменяется половым процессом с образованием гамет. Копуляция гамет приводит к образованию зиготы (ооцисты). Из кишечника кошки ооцисты выделяются во внешнюю среду, и здесь внутри каждой ооцисты формируется по восемь инвазионных спорозоитов. И вряд ли сегодня на нашей планете найдется место, не загрязненное ооцистами T.gondii!
Промежуточные хозяева заражаются друг от друга при съедании тканей (внимание, любители бифштекса с кровью!), содержащих цисты с брадизоитами, а окончательные - при поедании инфицированных промежуточных хозяев (например, грызунов и птиц). И те, и другие хозяева могут случайно проглотить ооцисты с загрязненных предметов, а у млекопитающих возбудитель передается еще и от матери к плоду, нередко вызывая дефекты развития ребенка (важно знать будущим матерям!).
Несмотря на то, что жизненный цикл T.gondii был расшифрован более 30 лет назад, до сих пор нет ответа, по крайней мере, на два вопроса. Все еще остается загадкой, почему столь “неразборчивый” в выборе хозяина и места локализации патоген не развивается в клетках эпителия кишечника промежуточного хозяина? И почему энтероэпителиальное развитие паразита и образование ооцист возможно только в организме кошачьих?
Для ответа на эти вопросы мы впервые в качестве критерия оценки происходящих событий использовали структуру паразитофорной вакуоли и получили неожиданные результаты. Оказалось, что в процессе эволюции кокцидий изменяется не только морфо-функциональная организация самих паразитов, но и структура заключающей их паразитофорной вакуоли. Последнее обусловлено возникающими различиями в биохимическом составе секреторных гранул у разных бесполых стадий жизненного цикла (спорозоитов, тахизоитов, брадизоитов). И именно это в итоге определяет роль каждой отдельной стадии в осуществлении жизненного цикла паразита при его усложнении (т.е. при переходе к гетероксенности).
Способностью проникать в клетку по принципу троянского коня обладают только бесполые стадии развития кокцидий - спорозоиты или мерозоиты (в том числе тахи- и брадизоиты T.gondii), обозначаемые единым термином - зоиты. И такой способ проникновения не имеет аналогов среди про- и эукариотных микроорганизмов. Зоиты кокцидий - типичные эукариотные клетки веретенообразной формы размером около (5-7)ґ(2-3) мкм, которые наряду с характерными органеллами содержат дополнительный уникальной комплекс цитоплазматических структур: микронемы, роптрии и плотные гранулы. Выяснилось, что присутствие этих секреторных органелл в зоитах T.gondii имеет прямое отношение к процессу внедрения паразита в клетку [13].
Схема строения зоита кокцидий. Секреторные белки синтезируются в шероховатой эндоплазматической сети, после чего проходят через аппарат Гольджи и попадают в соответствующие органеллы [14]. Последовательный экзоцитоз содержимого микронем, роптрий и плотных гранул осуществляется в апикальной части зоита. Сначала выделяются белки микронем, обеспечивая прикрепление паразита к поверхности клетки. Затем происходит встраивание белков и липидов роптрий и белков микронем в инвагинированную плазматическую мембрану, т.е. в мембрану будущей паразитофорной вакуоли. Содержимое плотных гранул секретируется в пространство паразитофорной вакуоли уже после того, как паразит оказывается в клетке хозяина, и далее участвует в поддержании внутренней среды вакуоли.
В подавляющем большинстве случаев внутриклеточные стадии развития кокцидий окружены одномембранной паразитофорной вакуолью, происходящей от плазматической мембраны зараженной клетки, что характерно и для тахизоитов T.gondii. В отличие от этого, энтероэпителиальные стадии в кишечнике кошки окружены трехмембранной паразитофорной вакуолью. До последнего времени в мировой литературе подобным различиям не придавали какого-либо значения, и все сводилось лишь к простой констатации факта. Сравнительный анализ имеющихся данных показал, что трехмембранная паразитофорная вакуоль заключает внутри себя энтероэпителиальные стадии как T.gondii, так и других гетероксенных кокцидий (Cystoisospora, Sarcocystis, Hammondia, Frenkelia), у которых роль окончательного хозяина выполняет хищное животное. А у гомоксенных (однохозяинных) кокцидий рода Eimeria, паразитирующих в кишечнике нехищных хозяев, энтероэпителиальные стадии всегда окружены только одномембранной паразитофорной вакуолью.
Таким образом, возникновение трехмембранной паразитофорной вакуоли вокруг эндогенных стадий паразита безусловно коррелирует с эволюцией гомоксенных жизненных циклов кишечных кокцидий в сторону гетероксенности, т.е. приобретения паразитом двух хозяев - промежуточного и окончательного, и возникновением межхозяинных отношений по принципу “жертва - хищник”. В промежуточном хозяине токсоплазма развивается в клетках практически всех внутренних органов, за исключением энтероцитов кишечника, а в окончательном хозяине развитие паразита становится преимущественно энтероэпителиальным.
Оказалось, что по количеству и составу белкового секрета плотных гранул и роптрий тахизоиты T. gondii отличаются от брадизоитов. И указанные различия во многом определяют структуру паразитофорной вакуоли, заключающей эти стадии [15].
Исследования показали, что тахизоиты T.gondii с высоким содержанием секрета роптрий и плотных гранул стимулируют образование только одномембранной паразитофорной вакуоли, тогда как брадизоиты, в которых такого секрета в несколько раз меньше, развиваются внутри трехмембранной паразитофорной вакуоли.
Электронограммы зоитов Toxoplasma gondii. В макрофаге мыши (справа, D.J.P.Fergusson) зоит окружен одномембранной паразитофорной вакуолью (показано стрелкой), а в энтероците кишечника кошки (слева, E.Scholtyseck, J.P.Overdulve) - трехмембранной паразитофорной вакуолью (отмечено стрелками).
На первый взгляд все должно быть совсем наоборот. Однако следует учесть, что в основе образования обоих типов паразитофорных вакуолей лежит одна и та же одиночная инвагинированная плазматическая мембрана, а трехмембранная “стенка” формируется вторично, за счет присоединения к исходной мембране еще двух мембран цистерны эндоплазматической сети. Поэтому само прикрепление мембран зависит не от количества секрета у зоита, а от качества, т.е. наличия определенного набора специфических белков. Один из них, ROP2, был недавно выявлен в роптриях брадизоитов T.gondii [16].
Итак, развитие T.gondii в кишечнике кошки возможно после проникновения в энтероциты только тех стадий, которые стимулируют формирование не одно-, а трехмембранной паразитофорной вакуоли, и такими стадиями оказываются брадизоиты, но не тахизоиты или спорозоиты. И в этом состоит принципиальное различие между гетероксенными цистообразующими кокцидиями и гомоксенными кокцидиями рода Eimeria. У всех видов Eimeria развитие в кишечнике хозяина всегда начинается со стадии спорозоита, и все стадии окружены одномембранной паразитофорной вакуолью. В отличие от этого ни спорозоиты, ни тахизоиты Toxoplasma не могут развиваться в энтероцитах кишечника из-за их неспособности сформировать вокруг себя трехмембранную паразитофорную вакуоль.
Высокое содержание белков плотных гранул и роптрий в тахизоитах может рассматриваться как эволюционный запрет только на развитие этих стадий в энтероцитах кишечника хозяина, но не на возможность проникновения в них. Оказалось, что тахизоиты могут активно проникать в энтероциты и так же легко их покидать, не формируя при этом никаких вакуолей [17]. Создается впечатление, что, внедряясь в клетку, тахизоит мгновенно “оценивает” не только ее пригодность или непригодность для своего дальнейшего развития, но собственную способность или неспособность обосноваться в такой клетке.
Молекулярная организация брадизоитов также накладывает безусловное ограничение на выбор ими клеток для своего последующего развития, сводя этот выбор фактически до одного-единственного варианта - энтероцитов кишечника кошачьих.
Можно предположить, что у кокцидий с гетероксенными жизненными циклами главная “ответственность” за выживание паразита как вида ложится на окончательного хозяина-хищника, поскольку именно в нем совершается половая фаза развития паразита, включающая обмен генетической информацией между разными штаммами, а также образуются устойчивые стадии (ооцисты), обеспечивающие распространение патогена во внешней среде. С этой “ответственностью”, возможно, отчасти связано и хорошо известное практически бессимптомное течение токсоплазмоза у кошачьих [18]. В отличие от этого, для многочисленных промежуточных хозяев T.gondii, в которых происходит только умножение бесполых стадий, характерна достаточно высокая смертность.
Все еще остается нерешенной вторая из двух загадок: почему из всего множества хищников токсоплазма “выбрала” в качестве окончательных хозяев представителей только семейства кошачьих? А почему не псовых или куньих, как у других цистообразующих кокцидий? Пока еще этого никто не знает. Надеемся, что вскоре нам удастся раскрыть и эту тайну.
Работа выполнена при поддержке Российского фонда фундаментальных исследований.
Проекты 95-04-11068, 01-04-49322, 02-04-49338, 02-04-06777, 03-04-06525.
Литература
1.Frenkel J.K. // Ztschr. Parasitenk. 1974. №45. P. 125-162.
2.Tenter A.M., Heckeroth A.R., Weiss L.M. // Int. J. Parasitol. 2000. №30. Р. 1217-1258.
3.Бейер Т.В. Клетка в клетке, или “Бомба” замедленного действия.// Природа. 2000. №7. С. 13-19.
4.Уголев А.М. Эволюция пищеварения и принципы эволюции функций: элементы современного функцианализа. Л., 1967.
5.Mauel J. // Immunology. 1982. №161. Р. 392-400.
6.Klebanoff S.J., Locksley R.M., Jong E.C., Rosen H. Oxidative response of phagocytes to parasite invasion. Cytopathology of parasitic diseases. Ciba Found. Symp. London, 1983. №99. Р. 92-112.
7.Hall B.F., Joiner K.A. // Parasitol. Today. 1991. №7. P. A22-A27.
8.Mordue D., Hakansson S., Niesman I., Sibley D. //Exper. Parasitol. 1999. №92. P. 87-99.
9.Beyer T.V., Svezhova N.V., Radchenko A.I., Sidorenko N.V. // Cell Biol. Intern. 2002. №26. Р. 861-871.
10.Бейер Т.В., Свежова Н.В., Радченко А.И., Сидоренко Н.В. // Цитология. 2003. Т. 45. №4. Р. 339-356.
11.Бейер Т.В. Метаболизм Toxoplasma gondii. Токсоплазмиды // Протозоология. Вып. 4. Л., 1979. С. 49-62.
12.Бейер Т.В. Клеточная биология споровиков - возбудителей протозойных болезней животных и человека. Л., 1989.
13.Dubremetz J.F. // Trends Microbiol. 1998. №6. Р. 27-36.
14.Hoppe H.C., Ngo H.M., Yang M., Joiner K.A.// Nature Cell Biol. 2000. №2. P. 449-456.
15.Fergusson D.J.P. // J. Protozool. Res. 1999. №9. Р 141-151.
16.Sinai A.P., Joiner K.A. // J. Cell Biol. 2001. №154. Р. 95-105.
17.Speer C.A., Dubey J.P. //Parasitology. 1997. №116. P. 35-42.
18.Dubey J.P. // Feline Pract. 1986. №16. Р. 12-45.