№6, 2003 г.
© Л.М. Эпштейн, Е.С. Шубина
Многоликая водородная связь
Л.М. Эпштейн, Е.С. Шубина
Лина Мееровна Эпштейн, - доктор химических наук, профессор,
ведущий научный сотрудник Института элементоорганических соединений им. А.Н. Несмеянова РАН.Елена Соломоновна Шубина, доктор химических наук,
руководитель группы гидридов металлов того же института.Усилия многих поколений химиков-синтетиков были направлены на получение новых соединений за счет разрыва одних химических связей и последующего образования новых. Но не меньший интерес они проявляли к водородной связи, которая появляется не в результате синтеза, а возникает при подходящих условиях сама, как аромат у заботливо выращенного и распустившегося цветка.
Водородная связь, о которой пойдет речь, имеет глобальный характер, ее терпкий аромат буквально пронизывает всю химию. К настоящему времени учение о водородной связи представляет собой крупную главу в химической науке.
Связь слабая, но не бессильная
Отличительная черта водородной связи - сравнительно низкая ее энергия, она почти на порядок ниже энергии химической связи и занимает промежуточное положение между химическими связями и ван-дер-ваальсовыми взаимодействиями, которые удерживают молекулы в твердой или жидкой фазе (рис.1).
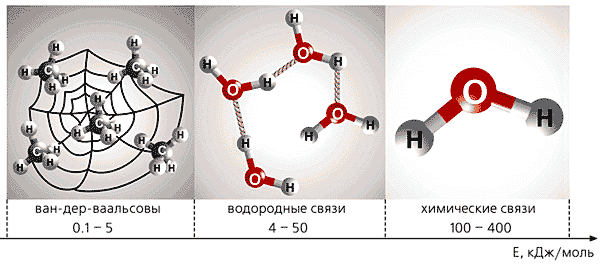
Рис. 1. Энергия трех типов связи.
Видно, что энергия водородной связи много меньше, чем химической,
но почти на порядок превышает энергию ван-дер-ваальсовых взаимодействий.Само понятие и термин "водородная связь" ввели В.Латимер и Р.Родебуш в 1920 г., чтобы объяснить высокие температуры кипения воды, жидкого HF и некоторых других соединений. Вначале полагали, что водородная связь (Н-связь) возникает в том случае, когда атом водорода в молекуле соединен с элементом, имеющим высокую отрицательность, как правило с элементом второй группы (кислородом, азотом, фтором). Водород при этом приобретает частичный положительный заряд, благодаря чему притягивает другую молекулу, также содержащую электроотрицательный элемент. Таким образом, в образовании Н-связи участвуют три атома: два электроотрицательных (А и Б) и находящийся между ними атом водорода - Б---Нd+-Аd- (водородную связь обычно обозначают пунктирной линией). Атом А условно называют донором протона, а Б - его акцептором (условно, потому что истинного "донорства" может и не быть, нередко Н остается химически связанным с А). Согласно современной точке зрения, в образование Н-связи помимо электростатических сил большой вклад вносит поляризация партнеров и частичный перенос заряда. Иногда А и Б - атомы одного и того же элемента, например кислорода в молекуле воды.
Н-связи охватывают громадное количество разнообразных веществ, они заметно усиливают ассоциацию молекул в твердой либо жидкой фазе, что приводит соответственно к повышению температуры плавления или кипения. Расчет показывает, что если бы водородные связи не существовали, температура кипения воды была бы на 200° ниже.
Гидроксильные группы, расположенные по всей длине полимерной молекулы целлюлозы, приводят к столь мощной межмолекулярной ассоциации, что растворить этот полимер удается лишь в довольно экзотическом высокополярном растворителе - реактиве Швейцера.
Н-связи, возникающие между карбонильными и аминогруппами >С=О---Н-N<, формируют кристаллическую структуру полиамидов и полиуретанов, определяют также структуру белков, нуклеиновых кислот и других биологически важных молекул. В некоторых технологических процессах, скажем адсорбции и экстракции, участие водородных связей исключительно важно. Они оказывают влияние на многие химические реакции, например, их образование может предшествовать переносу протона от одной молекулы к другой.
Исследования взаимодействий элементоорганических соединений с донорами протонов открыли новую страницу в учении о водородных связях.
Как обнаружить водородную связь?
Помимо косвенных способов выявления водородной связи (повышение tкип и др.) существуют более конкретные и информативные методы, прежде всего спектральные, такие как инфракрасная (ИК) и ЯМР-спектроскопия.
Первый метод позволяет удовлетворить естественную потребность каждого пытливого ума подергать и пошевелить подвижную конструкцию. При рассмотрении спектральных свойств химической связи ее можно уподобить упругой пружинке (рис.2). В любом соединении частота колебаний каждой группировки атомов зависит от их массы и упругости связывающих пружинок, иными словами, от природы химической связи. Чтобы выявить Н-связь, исследователь должен выбрать группировку и вид колебаний, наиболее информативные для этой цели. Чаще всего обращают внимание на частоту валентных колебаний А-Н-связей, а также на изменение частоты колебаний группы Б.
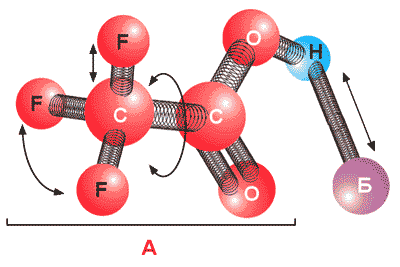
Рис. 2. Модель комплекса трифторуксусной кислоты с акцептором протона.При исследовании Н-связей информативна также ЯМР-спектроскопия. Изменение химического сдвига d-протона и его спин-спиновое взаимодействие с соседними ядрами позволяют определить некоторые параметры этой связи.
Анализируя ИК- и ЯМР-спектры, исследователь видит отчетливый след, который оставляет Н-связь, и по его "отпечатку" может не только установить сам факт присутствия этой связи, но и количественно оценить энергетические и структурные характеристики.
Новый поворот
Планомерными исследованиями круг акцепторов протона был заметно расширен; выявлена способность некоторых элементов с пониженной, в сравнении с элементами второго периода, электроотрицательностью (например, S, P, As и др.) включаться в подобные взаимодействия. Общий признак акцепторных центров - наличие неподеленной пары электронов. Это привело к мысли, что в образование водородных связей можно вовлечь атомы металлов. Из общих соображений было понятно, что к образованию Н-связи в роли акцепторов протонов должны быть склонны комплексы переходных металлов. Эксперименты показали, что наиболее охотно участвуют в подобном альянсе комплексы металлов VI-VIII групп [1].
Мы выбрали сначала комплекс иридия, а в качестве донора протонов - трифторуксусную кислоту (CF3COOH) и наблюдали за превращениями в системе при разных температурах. Индикатором превращений послужила полоса в ИК-спектрах, соответствующая колебаниям карбонильной группы C=O в трифторуксусной кислоте (рис.3). На первой стадии возникает Н-связь с атомом металла, на что указывает полоса валентных колебаний n=1730 см-1 в комплексе I (та же группировка без Н-связи имеет заметно более высокую частоту колебаний: n=1780-1800 см-1). При понижении температуры металл протонируется и образуется обычная s-связь М-Н. Все превращения обратимы, протон как бы зажат между двумя пружинками и может передвигаться влево либо вправо в зависимости от температуры. Металлокомплекс II, принимая протон, становится катионом.
Ранее мы упоминали, что выбор металлокомплексов, взятых для исследования, не был случайным. Точно так же при выборе донора протона (молекулы Нd+-Аd-) мы учитывали ряд факторов. Обычный спирт ROH - слабый донор, в результате реакция останавливается на стадии первичного образования
Н-связи: М---Нd+-Аd-. Сильная кислота CF3COOH приводит к легкому переносу протона на металлокомплекс, поэтому не удается зафиксировать некоторые промежуточные стадии (см. рис.3). Экспериментально мы смогли отыскать доноры "средней силы" - CF3CН2OН (трифторэтанол), (CF3)2CHOH (гексафторизопропанол) и некоторые другие. Такие доноры позволили превратить исследуемую систему в регулируемую, после чего можно было не только фиксировать все переходы протона, но и оценивать энергетические параметры превращений.Таким образом, в нашем распоряжении оказались три рычага, чтобы управлять механизмом перемещения водорода: особенности строения металлокомплекса, химическая природа донора протонов и температура.
Водород самодостаточен
Еще более необычные, по сравнению с только что описанными, превращения можно наблюдать в том случае, если на роль акцептора (атома Б) назначить сам водород, для чего необходимо создать на нем отрицательный заряд [2]. Именно это реализуется в гидридах металлов Мd+-Нd- (такой водород и называют гидридным).
В наших исследованиях комплекс рутения, содержащий гидридный водород, был способен образовывать Н-связь с донором протона (CF3)2CHOH. В результате возникал необычный водородный мостик, где двуликий водород сам с собой организовывал Н-связь: Мd+-Нd----Нd+-Аd- (рис.4). Однако то была лишь первая стадия превращений. Очевидно, что пара стоящих рядом атомов водорода Нd----Нd+ представляет собой заготовку для нейтральной молекулы Н2, и, разумеется, водород не упускает предоставленной возможности. В итоге молекула перестраивается, Н-связь исчезает и возникает комплекс, содержащий новый лиганд - молекулярный водород [3]. Следить за происходящими превращениями позволяет полоса валентных колебаний карбонильного лиганда -С=О. Этот лиганд - удобный спектральный индикатор при переносе протона, так как исключительно чувствителен к изменениям, происходящим в молекуле металлокомплекса. Интересно, что в данном случае возникшая ионная пара также стабилизируется нестандартной Н-связью между анионом и лигандом - молекулярным водородом.
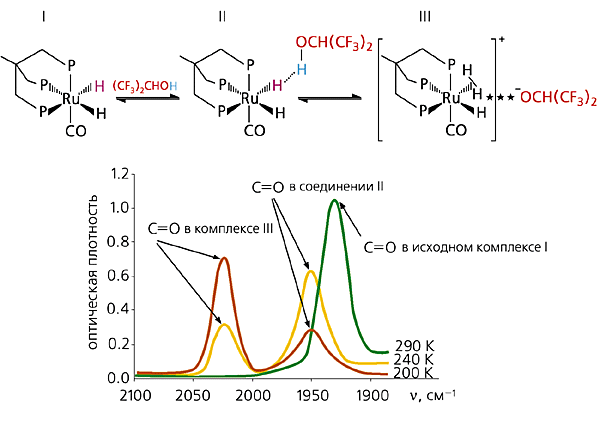
Рис. 4. Возникновение, дальнейшие превращения диводородной связи
и ИК-спектры комплексов рутения.Все превращения обратимы: при низкой температуре равновесие смещено в сторону образования комплекса с молекулярным водородом, о чем свидетельствует увеличение интенсивности полосы в области 2020 см-1) для комплекса III; при повышении температуры равновесие сдвигается к исходному соединению, на это указывает увеличение интенсивности полосы 1920 см-1 исходного гидридного комплекса I. Промежуточное соединение - диводородный комплекс II (полоса 1950 см-1) - в зависимости от температуры плавно переходит либо в исходное, либо в конечное соединение (полоса 2020 см-1) [3].
Детально изучив межмолекулярную диводородную связь, по данным спектров ЯМР-1Н и рентгеноструктурного анализа мы установили, что расстояние Нd----Нd+ зависит от структуры комплекса и находится в диапазоне 1.7-1.9 А. Эта величина меньше суммы ван-дер-ваальсовых радиусов двух атомов водорода (2.4 А), что подтверждает существование такой связи [4].
По интенсивности полос ИК-спектров мы вычислили константы равновесия для каждой стадии, а так как константы зависели от температуры, нам удалось определить энтальпию образования каждого соединения. Для комплекса II c диводородной связью она составила 31 кДж/моль, для комплекса III с молекулярным водородом - 36.5 кДж/моль. Таким образом, необычная диводородная связь совсем не слабая, ее образование вносит значительный вклад в энергию всего процесса [5].
Можно сказать, что обсуждаемая нами связь - явление в некотором роде экзотическое, характерное для гидридных комплексов и не имеющее аналогов в органической химии.
Все существующие к настоящему времени литературные данные показывают, что водородная связь охватывает самые разнообразные превращения с участием широкого набора химических элементов [4].
Прогулки водорода по металлокомплексам
Теперь, когда мы в общих чертах познакомились с характером протона, попробуем найти логику в его поведении. При взаимодействии с металлокомплексом, содержащим разные лиганды, непоседливый протон каждый раз решает, следует ли ему направиться в первую очередь к металлу или к лиганду, и к какому именно.
Чтобы проследить за движением протона, упростим систему, будем менять лиганды у металла, оставив неизменными сам металл и протонодонор (рис.5). Выбрав донор протона средней силы (перфтор-трет-бутанол), мы смогли зафиксировать переходные стадии [6].
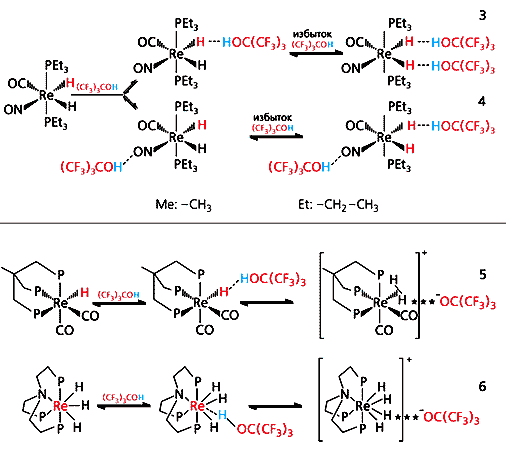
Рис. 5. Влияние разных лигандов на направление реакции.
Если в комплексе рения присутствует лиганд с высокой акцепторной способностью, например Cl-, протон в первую очередь направляется к нему (рис.5, схема 1). Затем, при избытке протонного донора, возникает диводородная связь с участием гидридного водорода. Если Cl- отсутствует, два гидридных водорода один за другим образуют такую же связь (рис.5, схема 2). Теперь заменим метильные группы в фосфиновых лигандах этильными. В комплексе с такими лигандами Н-связи могут возникать как с NО, так и с одним из гидридных водородов (рис.5, схемы 3 и 4). Второй же вовлекается в образование связи лишь при избытке донора.
В рассмотренных случаях мягкий донор протона доводит реакцию до появления водородной связи. Однако с участием того же донора можно процесс провести глубже, если за счет лигандов увеличить акцепторные свойства комплекса. Тогда вначале возникают Н-связи, а при понижении температуры либо образуется комплекс с молекулярным водородом (рис.5, схема 5), либо протонируется металл (рис.5, схема 6) [7, 8].
Системой можно управлять, меняя не только лигандное окружение, но и атом металла в комплексе. Так, если это молибденовый комплекс, то он содержит гидридные водороды с довольно высокой основностью. Поэтому легко образуется диводородная связь (рис.6). Если молибден заменить вольфрамом, имеющим большую основность, гидридные водороды не выдержат конкуренции, и предпочтительным окажется образование Н-связи с металлом (рис.6).
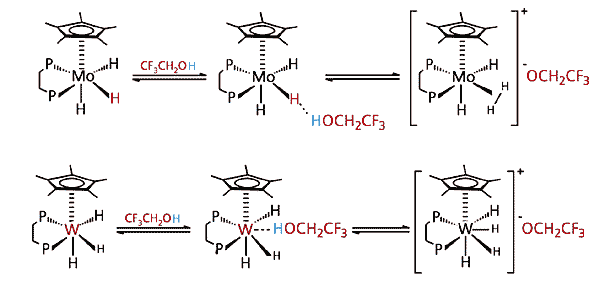
Рис. 6. Влияние металла на направление реакции.Перестраивание молекул, напоминающее картинки в калейдоскопе, интересно не только само по себе, оно приводит к важным выводам. Протон - уникальный химический реагент, представляющий собой элементарную частицу, размеры которой в несколько тысяч раз меньше любого атома. Всепроникающая способность протона превращает его в тонкий исследовательский инструмент, позволяющий изучать разнообразные химические превращения. Необходимо лишь научиться им управлять.

Работа выполнена при поддержке Российского фонда фундаментальных исследований. Проект 99-03-33270а.
Литература
1. Shubina E.S., Belkova N.V., Epstein L.M. // J. Organomet. Chem. 1997. V.536-537. P.17-29.
2. Shubina E. S., Belkova N. V., Krylov A. N. et al. // J. Am. Chem. Soc. 1996. V.118. P.1105-1112.
3. Bakhmutov V.I., Bakhmutova E.V., Belkova N.V. et al. // Can. J. Chem. 2001. V.79. P.479-489.
4. Шубина Е.С., Белкова Н.В., Сайткулова Л.Н. и др. // Известия РАН. Сер. химическая. 1998. Т.5. С.846-852.
5. Epstein L.M., Belkova N.V., Shubina E.S. Dihydrogen bonded complexes and proton transfer to hydride ligand by spectral (IR, NMR) studies // Recent advances in Hydride Chemistry. Amsterdam, 2001. P.391-418.
6. Belkova N.V., Shubina E.S., Epstein L.M. et al. // J. Organomet. Chem. 2000. V.610. P.58-70.
7. Belkova N.V., Bakhmutova E.V., Shubina E.S. et al. // Eur. J. Inorg. Chem. 2001. P.2163-2165.
8. Albinati A., Bakhmutov V.I., Belkova N.V. et al. // Eur. J. Inorg. Chem. 2002. P.1530-1539.
Май 2003