№6, 2006 г.
© Львов Д.К., Забережный А.Д., Алипер Т.И.
Вирусы гриппа: события и прогнозы
Д.К. Львов, А.Д. Забережный, Т.И. Алипер
Дмитрий Константинович Львов, академик РАМН, директор НИИ вирусологии им.Д.И.Ивановского РАМН,
зав. каф. вирусологии ММА им.И.М.Сеченова.Алексей Дмитриевич Забережный, д.б.н., зав. лаб. молекулярной диагностики того же института,
руководитель отдела молекулярной биологии НПО “Нарвак”.Тарас Иванович Алипер, д.б.н., зав. лаб. средств специфической профилактики вирусных болезней того же института,
директор НПО “Нарвак”.Эпидемии гриппа происходят ежегодно и не воспринимаются как нечто экстраординарное. Поскольку заболевание вызывается уже знакомыми иммунной системе вирусами, она с ними, как правило, справляется. Другое дело пандемии: в этом случае возбудитель гриппа - вирус с новыми антигенными и биологическими свойствами, молниеносно распространяющийся в мире, поражающий до четверти населения планеты и уносящий десятки миллионов жизней. Этим “прославились” пандемии прошлого века. Предвидеть их было невозможно, как, впрочем, нельзя назвать точное время наступления новой. Однако сейчас благодаря постоянному слежению за циркулирующими среди людей, домашних и диких животных вирусами, а также знаниям, полученным с помощью молекулярно- генетических методов, уже можно прогнозировать появление новых вариантов вируса с пандемическими наклонностями. В последние годы претендент на эту роль выявлен: изначально непатогенный вирус птиц H5N1 в конце 2003 г. вызвал эпизоотию гриппа среди домашних птиц, перешедшую в этом году в панзоотию. Этот вирус начал поражать и других животных, в том числе и людей, но пока не может передаваться от человека к человеку. Чтобы он приобрел эту способность, достаточно замены всего одной аминокислоты в одном из вирусных белков.
Структуры вириона
Вирус гриппа устроен довольно просто: это сферической формы частица (вирион) диаметром около 0.13 мкм, в сердцевине которой находится нуклеокапсид (молекула РНК, упакованная в оболочку из белка М1), окруженный липидной мембраной. В эту мембрану погружены три белка - гемагглютинин, нейраминидаза и ионный канал (белок М2), играющие основную роль в инфекционном процессе.
Первым вступает в контакт с рецепторами клетки хозяина гемагглютинин. На поверхности вирусной оболочки он представлен в виде очень сложно устроенных тримеров. Каждый их мономер прочно заякорен в мембране и содержит две субъединицы - одна из них обеспечивает первичный контакт с клеткой-мишенью, другая отвечает за слияние вирусной и клеточной мембран. В верхней части белка расположены участки, которые связываются с сиаловой кислотой, входящей в состав рецептора клетки хозяина.
Схема вириона вируса гриппа. Его липопротеидная оболочка покрыта шипиками из двух гликопротеидов - гемагглютинина и нейраминидазы. Внутри находится нуклеокапсид - молекула РНК, упакованная в оболочку из белка М1. Геном состоит из восьми фрагментов, из которых первые шесть кодируют по одному белку (гемагглютинин - HA, нейраминидазу - NA, субъединицы РНК-полимеразы - PB1, PB2, PA, нуклеопротеид - NP), а последние два гена - по два белка с уникальными последовательностями аминокислот (матричные белки - M1, M2 и неструктурные белки - HS1, HS2).
Фермент нейраминидаза отщепляет концевые группы сиаловой кислоты клеточных рецепторов, в результате чего клетка теряет способность распознавать антиген, и вирус проникает в нее путем эндоцитоза - обычного способа доставки веществ в клетку. Кислая среда отпочковавшейся от клеточной мембраны эндосомы активирует ионный канал М2, который обеспечивает понижение рН внутри вирусной частицы, что приводит к разрушению белковой оболочки М1.
Одновременно активируется гемагглютинин. Синтезируется он в виде предшественника, который в кислой среде переходит в зрелое состояние - расщепляется протеолитическими ферментами на две субъединицы, при этом спрятанный внутри тримера пептид слияния меняет конформацию, выходит на свободу, перемещается в верхний конец молекулы и внедряется в мембрану. Вирусная оболочка сливается с эндосомальной, образуется пора слияния, через которую в цитоплазму открывается путь для чужеродного генетического материала. Затем вирусная РНК проникает в клеточное ядро. В результате в клетке нарушаются процессы жизнедеятельности и она сама, используя собственные ресурсы, начинает производить вирусные белки. Тут же происходит репликация вирусной РНК и сборка новых вирусных частиц, которые с помощью нейраминидазы высвобождаются из поврежденных клеток (при этом продукты их распада вызывают интоксикацию организма и лихорадочное состояние) и с кровотоком разносятся по всему организму.
Размножившийся вирус угнетает кроветворную и иммунную системы, повреждает эндотелий капилляров, что приводит к повышенной проницаемости сосудов и кровоизлияниям вплоть до отека мозга с летальным исходом. Но так происходит довольно редко, обычно включается иммунная система - сначала вовлекаются факторы врожденного (неспецифического) иммунитета, а через некоторое время начинают вырабатываться специфические антитела, освобождающие и при повторном заражении защищающие организм от вируса.
Отличительная особенность вирусов гриппа - высокая изменчивость антигенных свойств. Внутренние белки постоянны по своей структуре и определяют тип вируса (A, B и C). Поверхностные же антигены, напротив, гетерогенны и изменчивы, причем в большей степени это касается гемагглютинина (H), который наряду с нейраминидазой (N) определяет подтип вируса (H1N1, H2N2, H3N2 и т.д.). Антигенная изменчивость поверхностных белков обусловлена двумя генетическими процессами - дрейфовыми и шифтовыми изменениями вирусного генома.
Дрейфовые изменения вызываются точечными мутациями в генах, кодирующих гемагглютинин и нейраминидазу, и приводят к незначительным изменениям в структуре этих белков. Как правило, такие изменения происходят в период между пандемиями у всех типов вирусов (А, В и С). В результате ежегодно возникают эпидемии, а не пандемии, так как защита от предыдущих контактов с вирусом сохраняется, хоть она и недостаточна.
Шифтовые изменения возникают после полной замены гена. Это возможно, поскольку геном вируса гриппа сегментирован - состоит из восьми фрагментов однонитчатой линейной РНК, кодирующих помимо гемагглютинина и нейраминидазы вирусоспецифический фермент (РНК-полимеразу, или транскриптазу, состоящую из трех субъединиц - белков PB1, PB2, PA), а также нуклеопротеид (NP), матриксные (М1 и М2) и неструктурные (NS1 и NS2) белки. При одновременном заражении клетки двумя разными штаммами сегменты их реплицирующихся геномов смешиваются в любых сочетаниях, поэтому новые вирионы содержат разные наборы генов, заимствованные от каждого из исходных вирусов. Такое комбинирование сегментов вирусной РНК называют генетической перетасовкой, или реассортацией, чтобы не путать с уже существующим термином - рекомбинацией, в ходе которой генетический материал перестраивается либо по механизму кроссинговера, либо в результате смены матрицы. Шифтовые изменения, как правило, затрагивают антигенную структуру гемагглютинина, реже - нейраминидазы. Таким образом через нерегулярные интервалы времени (10-40 лет) появляются вирусы с новыми антигенными и биологическими свойствами, в том числе и новые пандемические варианты [1, 2].
Видовой барьер
Среди вирусов, способных вызывать чрезвычайные эпидемические ситуации, борьба с которыми на этапе их возникновения трудна или даже невозможна, особенно опасны вирусы гриппа А. Они характеризуются высокой антигенной гетерогенностью поверхностных белков и представлены, согласно номенклатуре, 16 подтипами гемагглютинина (H1-16) и 9 нейраминидазы (N1-9). Эти вирусы широко распространены в природе и могут поражать все виды птиц и некоторые виды млекопитающих (людей, лошадей, свиней, китов, тюленей и т.д.) [1, 2]. Заражение млекопитающих происходит в основном через дыхательные пути, птиц - через кишечник. Инфекция у них протекает, как правило, бессимптомно или в виде энтерита, что указывает на высокую степень взаимной адаптации вирусов гриппа и диких птиц, которых можно считать их естественными хозяевами. Вирус сохраняется в воде, при +22°С - до месяца, при +4°С и ниже - в течение более длительного времени (6-8 месяцев), поэтому водно-фекальный путь инфицирования - основной механизм поддержания постоянной циркуляции вируса гриппа в природе.
Несмотря на антигенную гетерогенность, вирусы со всеми известными сочетаниями поверхностных белков выделены только от диких птиц водного и околоводного комплексов (уток, чаек и т.д.). Среди других животных циркулируют лишь вирусы с определенным набором поверхностных белков: например, от людей до недавнего времени выделяли вирусы только трех подтипов гемагглютинина (Н1-Н3) и двух нейраминидазы (N1-N2). Все четыре пандемии ХХ в. были обусловлены новыми шифтовыми вариантами этих подтипов: “испанский грипп” в 1918 г. был вызван вирусом гриппа А подтипа H1N1, “азиатский грипп” в 1957 г. - H2N2, “гонконгский грипп” в 1968 г. - H3N2 и “русский грипп” в 1977 г. - H1N1. Все они - реассортанты вирусов гриппа птиц и человека [2].
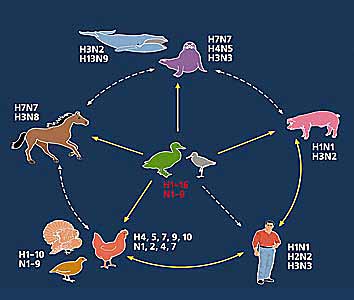
Схема циркуляции известных подтипов вирусов гриппа типа А.
До недавнего времени считалось, что вирусы гриппа птиц не патогенны для людей и в случае заражения могут вызвать у них лишь конъюнктивит и легкое недомогание, в редких случаях - слабовыраженный респираторный синдром. Однако в 1997 г. вирусы Н5N1 вызвали чрезвычайно тяжелые формы заболевания среди людей в Гонконге - из 18 заболевших человек шестеро погибли, причем все они заразились от цыплят. Второй подобный эпизод произошел в феврале 2003 г. и тоже в Гонконге - из пяти инфицированных людей двое умерло. Вирусы H5N1 периодически выделяли от кур и других видов птиц (в том числе и диких) в локальных популяциях [3].
Вирус серотипа H9N2, широко распространенный среди домашних птиц в Китае и других странах Азии, был обнаружен у пятерых китайцев в августе 1998 г., а спустя год в Гонконге у двух девочек с клиникой гриппоподобного заболевания. Примечательно, что все случаи заболеваний произошли независимо друг от друга, и передачи вирусов от человека к человеку не отмечено. В 1996 г. вирус гриппа птиц H7N7 был выделен от женщины, страдающей конъюнктивитом. Один случай в Нидерландах закончился смертью. Это только те случаи, которые официально зафиксированы, в реальности же вирусы гриппа птиц преодолевают видовой барьер, видимо, значительно чаще и начинают заражать не только человека, но и других животных (свиней, лошадей, китов, норок и т.д.). Известны случаи инфицирования домашних птиц (кур, индюков) вирусами гриппа, характерными для диких птиц, особенно водоплавающих [1-4].
Пока трудно уверенно судить о всех факторах, ограничивающих круг хозяев вируса, и механизмах, влияющих на смену хозяина. Поиск такой ведется, и уже довольно давно, в различных исследовательских группах, в том числе и в нашем институте.
Первым под подозрение попал гемагглютинин, поскольку именно этот гликопротеид ответствен за распознавание рецепторов хозяйской клетки и участвует в слиянии вирусной оболочки с эндосомальной (по сути - части цитоплазматической оболочки клетки хозяина). Структура этих рецепторов отличается в зависимости от видового и тканевого происхождения клеток. Эти различия важны для ограничения перехода вирусов между видами и исследованы специально в связи с возникновением новых пандемических для человека вирусов [5].
Установлено, что рецепторы эпителиальных клеток дыхательного тракта человека помимо белка содержат углеводы - сиалоолигосахариды, у которых концевая сиаловая кислота (N-ацетилнейраминовая кислота) соединена с галактозой связью 2ў-6ў, а рецепторы клеток эпителия кишечника птиц - 2ў-3ў. Птичьи вирусы гриппа плохо репродуцируются в организме человека, потому что просто не могут связаться с рецепторами человека. В то же время муцины (по природе те же сложные гликопротеиды с сиаловой кислотой на конце), которые обязаны защищать легкие человека от микроорганизмов, содержат рецепторы именно с 2ў-3ў галактозной связью. Таким образом, птичий вирус гриппа, случайно попавший в организм человека, проникнуть в клетки не может, так как на их поверхности нет специфических рецепторов, а распознающая активность рецепторов вирионов блокируются муцином, поэтому человеку в этом случае грозит лишь легкий насморк.
Но в таком случае чем же объяснить возникновение пандемических шифтовых вариантов вируса? Ситуация немного прояснилась, когда стало известно, что клетки респираторного тракта свиньи несут оба типа рецепторов и соответственно могут заражаться вирусами гриппа как человека, так и птиц. Это означает, что свиньи потенциально могут служить промежуточным хозяином разных вирусов и идеальной ареной для их реассортации при смешанной инфекции.
Что касается гемагглютинина, то его способность распознавать клеточные рецепторы хозяина, как оказалось, в первую очередь связана со структурой рецепторсвязывающего сайта (РСС). Так, у вирусов гриппа человека РСС содержит аминокислоты лейцин и серин в положениях 226 и 228 соответственно, а у птичьих вирусов в этих позициях находятся глутамин и глицин. Обнаружены и другие аминокислотные замены в РСС у разных животных, а это означает, что, хотя РСС консервативен и эволюционно устойчив, в нем все же есть вариабельные участки, влияющие на связывание с рецепторами (аффинитет) и специфичность [5].
Измениться РСС может после преодоления вирусом межвидового барьера, при этом вирусы гриппа птиц, например, могут приобрести способность распознавать рецепторы клеток человека. Доказательство того, что межвидовой барьер птица-человек может быть преодолен, - вспышка гриппа среди людей в Гонконге в 1997 г., вызванная птичьим вирусом H5N1.
Предполагается, что “привязанность” вируса к хозяину определяется не только особенностями гемагглютинина, но и другого поверхностного белка - нейраминидазы. Кроме того, есть основания считать, что в ограничении круга хозяев участвуют гены внутренних и неструктурных белков вирусов гриппа А. Однако говорить об этом пока рано, поскольку необходимо еще изучить вклад каждого гена и функции их продуктов. Как бы там ни было, важно понимать, что даже минимальные изменения в структуре вирусных белков, особенно гемагглютинина, могут вести к значительным изменениям не только в диапазоне хозяев вируса, но и степени его патогенности (вирулентности).
Вирулентность
Напомним, что для репродукции вируса в организме хозяина необходима активация предшественника молекулы гемагглютинина, при этом она расщепляется протеазами хозяина на две субъединицы. Протеолиз гемагглютининов низкопатогенных птичьих вирусов протекает в ограниченном числе типов клеток, поэтому вирус локализуется только в дыхательном или кишечном трактах. Так происходит при бессимптомной или средней тяжести инфекциях. Гемагглютинины высокопатогенных птичьих вирусов расщепляются в различных клетках и поэтому способны вызывать летальные системные инфекции, особенно у домашних птиц.
В различных лабораториях мира занялись исследованием генома высокопатогенных для людей штаммов вирусов гриппа (H5N1 и H7N7, выделенных в 1997-2004 гг.). Выяснилось, что эти вирусы содержат в сайте расщепления молекулы гемагглютинина несколько основных аминокислот, что и обеспечивает им высокую инфекционную активность и патогенность. В отличие от непатогенных или слабопатогенных вирусов, у которых этой аминокислотной последовательности нет, гемагглютинин высокопатогенных вирусов легко расщепляется не только трипсиноподобными протеазами, присутствующими в клетках респираторного тракта человека и кишечника птиц, но и фуриноподобными протеазами. Действуют они в комплексе с убиквитином, призванным помечать для протеаз белки, которые необходимо разрушить. Фуриноподобные протеазы синтезируются в разных тканях, что придает патогенным вирусам способность поражать разные системы и органы. Для превращения низкопатогенного вируса в высокопатогенный достаточно вставки даже одной основной аминокислоты в сайте протеолитического расщепления гемагглютинина [6].
Впоследствии это подтвердилось в опытах на мышах, инфицированных разными вариантами (выделенными в разные годы) вируса H5N1. Некоторые из них начали реплицироваться в мозге, печени, селезенке, клетках крови, вызывая 100%-ную гибель мышей на седьмые-восьмые сутки после заражения, тогда как другие вирусы оказались для мышей непатогенными и размножались только в легких. Вскоре и это объяснилось - у выделенных в 2004 г. вирусов H5N1 в сравнении с вирусами, полученными в 1997-2003 гг., выявлены дополнительные мутации в гене гемагглютинина, что отразилось на изменении их антигеных свойств.
На патогенность вируса могут влиять изменения в структуре не только поверхностных, но и внутренних белков. Так, обнаружена мутация в положении 627 в белке PB2 у высокопатогенного для мышей штамма вируса гриппа H5N1. Именно эта мутация повлияла на различие в свойствах двух вирусов H5N1, изолированных в Гонконге, и как следствие - на результат инфекционного процесса. Кроме того, вирулентность этих вирусов гриппа связывают с особенностями строения неструктурного белка NS, в частности, с присутствием в его молекуле глютаминовой кислоты в 92 положении, что придает вирусам устойчивость к антивирусному действию интерферонов.
Безусловно, использование современных молекулярно-генетических методов в изучении вирусов гриппа постепенно проясняет их биологические свойства, однако не менее важны и традиционные методы, с помощью которых ведется мониторинг циркуляции вирусов гриппа среди людей, домашних и диких животных. Прогнозирование появления реассортантов с пандемическими наклонностями и разработка эффективных мер профилактики и борьбы с гриппом могут быть выработаны лишь на основе изучения экологии и эволюции возбудителей этого трудно предсказуемого и трудно контролируемого инфекционного заболевания. Такие исследования начаты более 35 лет назад Г.Лейвером в Австралии, Р.Вебстером в США, Д.К.Львовым в нашей стране, и ведутся они по сей день во всем мире.
События и прогнозы
Всестороннее изучение вирусов гриппа А инициировано Всемирной организацией здравоохранения (ВОЗ) после пандемии в 1968 г., вызванной вирусом H3N2. В нашем институте установлено, что прародителем H3N2 был штамм, аналогичный вирусу H3N8, выделенному на Украине в 1963 г. от диких уток [4]. Эти и другие данные послужили основанием для развития научного направления - экологии и эволюции вирусов гриппа А. Был создан Национальный центр по экологии вирусов гриппа А с сетью опорных баз, где получены новые данные, подтвердившие отсутствие принципиальных отличий между вирусами гриппа А человека и животных, т.е. наличия единого защищенного генофонда. Согласно этим данным, в 1980 г. создана классификация вирусов гриппа независимо от их происхождения. С тех пор каждому выделенному вирусу присваивается название, где отражены тип вируса, источник выделения, место и год выделения, а также подтип - например, А/утка/Украина/63(H3N8).
Основной задачей наших исследований в России было изучение эволюции вирусов гриппа А в процессе взаимодействия вирусных популяций с популяциями диких птиц и домашних животных и формирования штаммов с эпидемической потенцией. Для этого проводится мониторинг в ключевых точках Северной Евразии; выделены 14 из 16 известных вирусов [1, 4].
Чомга (слева) и горный гусь. Летняя эпизоотия 2005 г. среди домашних птиц в Новосибирской обл. была вызвана выделенным от чомги высокопатогенным вариантом вируса H5N1, который оказался генетически идентичным штамму, выделенному весной того же года от горного гуся в северо-западной провинции Китая. Фото К.ван Ордена и Н.В.Паклиной
Был сделан и второй прогноз: в случае заражения в местах зимовок диких птиц высокопатогенными штаммами возрастает риск их занесения на территорию России, особенно в Сибирь и на Дальний Восток, во время весенних миграций. А затем произошло то, что и должно было произойти. В середине июля 2005 г. в населенных пунктах Новосибирской обл., расположенных в пределах озерной северной лесостепи Барабинской низменности, выявлена эпизоотия среди домашних птиц с летальностью свыше 90% и быстрым распространением.
Были собраны материалы от домашних и диких птиц, обитавших в непосредственной близости от места эпизоотии. Используя клеточные линии CПЭВ и MDCK (этот нестандартный метод проходит сейчас патентование), мы выделили шесть штаммов H5N1 от домашних птиц и чомги (Podiceps cristatus), причем концентрации вируса в тканях были очень высокими. С приоритетом от 8 августа 2005 г. эти штаммы депонированы в Государственную коллекцию вирусов, а данные секвенирования их полноразмерного генома заложены в GenBank с приоритетом от 5 сентября 2005 г. [7]. Сайт протеолитического нарезания гемагглютинина всех полученных штаммов содержит аминокислотную последовательность PQGERRRKKRGLF, характерную для высокопатогенных вирусов гриппа птиц. Нуклеотидные последовательности генов гемагглютинина всех анализируемых вирусов домашних птиц оказались полностью идентичными, но отличаются от штамма, выделенного от дикой птицы (чомги), правда, всего двумя нуклеотидными заменами. Филогенетический анализ выявил высокий уровень гомологии гемагглютининов западносибирских штаммов со штаммами, изолированными весной того же года от горного гуся (Anser indicus) на оз.Кукунор в северо-западной провинции Цинхай (КНР). Это полностью подтвердилось при анализе остальных семи генов [8, 9].
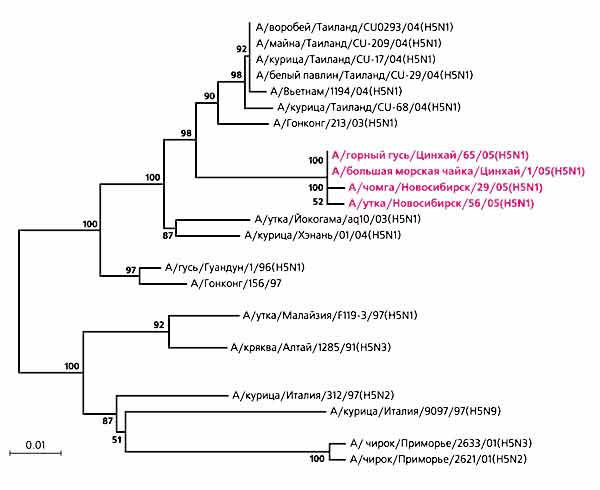
Степень родства нуклеотидных последовательностей гена гемагглютинина вариантов вируса гриппа А подтипа Н5,
изолированных от диких и домашних птиц в разных странах в последние 10 лет.
Цветом выделены высокопатогенные штаммы H5N1 цинхайско-новосибирской группы вирусов.Идентичность генетических характеристик изолированных штаммов доказывает непосредственную связь между вирусами, циркулирующими в популяциях диких и домашних птиц. Вместе с тем обнаруженные в 2005 г. штаммы вируса гриппа H5N1 существенно отличаются от штаммов этого вируса, выделенных в предыдущие годы, в том числе и от полученного из Англии штамма А/Вьетнам/1194/2004(H5N1), предлагаемого у нас в стране для производства вакцины. Очевидно, что по крайней мере для ветеринарной вакцины может быть использован только штамм из Государственной коллекции вирусов, соответствующий по антигенным свойствам циркулирующему в России вирусу. Выделенный нами штамм, депонированный в Государственную коллекцию вирусов, уже используется для крупномасштабного производства вакцины на ФГУП «Ставропольская птицефабрика». Вакцинируются домашние птицы в Южном федеральном округе. К 15 июня 2006 г. планируется произвести 15 млн доз вакцины с дальнейшим расширением производства.
К слову, в условиях пандемии, когда надо быстро наладить производство вакцины, целесообразно, на наш взгляд, использовать в качестве субстрата линии клеток, в которых вирус гриппа быстро накапливается в высоких концентрациях. Этот недавно разработанный метод обладает существенными преимуществами по сравнению с традиционным, в котором используются куриные эмбрионы: при сохранении всех антигенных доменов гемагглютинина культуральная вакцина исключает появление осложнений, связанных с куриным белком. Это особенно важно при производстве вакцины для людей. Вот только надо знать, какой штамм следует использовать для иммунизации людей. Это будет зависеть от антигенной характеристики возникшего пандемичного варианта. Возможно, он будет отличаться от того, что есть сейчас. В любом случае абсолютно недопустимо использование живой вакцины. Генетическое взаимодействие вакцинных и полевых вирусов может привести к возникновению реассортантов с непредсказуемыми последствиями.
Анализ генома выделенных нами штаммов выявил ряд особенностей, связанных с биологическими свойствами. Помимо аминокислотной последовательности сайта протеолитического расщепления гемагглютинина, определяющей высокий уровень патогенности вируса, обнаружены делеции в положении 49-68 в нейраминидазе (генотип Z), что указывает на повышенный тропизм выделенных нами вирусов к домашним птицам и потенциальную патогенность для людей. Глютаминовая кислота в 92-й позиции белка NS1 определяет устойчивость вируса к действию интерферона и повышенную вирулентность для свиней. Лизин в позиции 627 белка PB2 объясняет способность изучаемых штаммов к репродукции в различных линиях клеток млекопитающих. Выявленные свойства проникшего на территорию России вируса свидетельствуют о его высокой патогенности в отношении домашних птиц и людей [8].
Наличие серина, а не аспарагина, в 31-й позиции M2 указывает на чувствительность вируса к ремантадину, что полностью совпало с данными прямого изучения влияния противовирусных препаратов на репродукцию вируса. Для этих целей мы также использовали клеточные линии и выяснили, что для профилактики и раннего лечения гриппа одинаково эффективны и могут быть использованы как дорогостоящие зарубежные препараты - например, тамифлю, так и относительно дешевые отечественные, которые есть в аптеках, - ремантадин, виразол (при внутривенном и аэрозольном применении), арбидол [10]. К сожалению, производство этих препаратов сейчас в стране отсутствует или недостаточно, и необходимо срочно создать их стратегические запасы.
Каким же образом и когда проник высокопатогенный вирус гриппа Н5N1 на территорию России, и как будут развиваться дальнейшие события? * * *
Сначала низкопатогенные штаммы, циркулирующие в Сибири и на Дальнем Востоке среди диких птиц, были занесены во время осенних миграций в страны Юго-Восточной Азии. Превратившись там в высокопатогенные, они с дикими же птицами весной 2005 г. проникли в Западную Сибирь и резко активизировались в период появления птенцов. Высокопатогенные штаммы разлетелись с птицами в места гнездовий на территории более 10 млн км2. После попадания вируса в популяции домашних птиц произошел взрыв эпизоотии. Это всерьез и надолго.
Третий прогноз заключался в том, что когда осенью птицы полетят обратно в места зимовок через густонаселенные территории России и других стран, они вновь разнесут вирус. Так и произошло. Осенью 2005 г. вирус уже долетел до большинства европейских стран, обнаружен он и в Турции, Крыму, Иране, Азербайджане, Грузии, Индии, а также в Африке. А у нас добрался до Тулы, Калмыкии и дельты Волги, где вспышка гриппа в популяции лебедя-шипуна (Cygnus olor) возникла в декабре 2005 г. после короткой остановки пролетающих северных уток - хохлатых чернетей (Aythya fuligula). Изолированные от лебедей штаммы, по данным их молекулярно-генетического анализа, также относятся к цинхайско-западносибирской группе вирусов. За полгода циркуляции среди диких птиц штаммы сохранили генотип и не потеряли высокой патогенности.
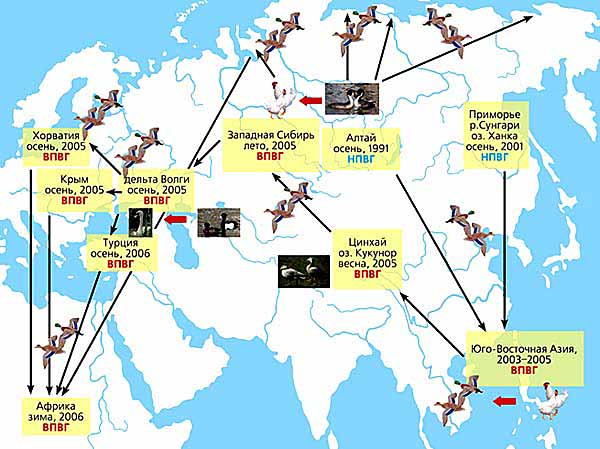
Пути распространения вируса гриппа Н5N1 в популяциях диких и домашних птиц.
Низкопатогенные вирусы гриппа (НПВГ), выделенные от диких и домашних птиц в северо-восточной области Алтайского края в 1991 г. и на юге Приморского края в 2001 г., очевидно, были предшественниками вспышки гриппа в Гонконге в 1997 г. и эпизоотий на юго-востоке Азии в 2003-2005 гг., а также на северо-западе Китая в 2005 г. Став высокопатогенными (ВПВГ), эти вирусы проникли во время весенней миграции диких птиц в Западную Сибирь, где летом 2005 г. вызвали вспышку гриппа среди домашних птиц. В период миграции птиц водного и околоводного комплекса произошло дальнейшее распространение ВПВГ на север и запад Евразии, а зимой 2006 г. эти вирусы уже были обнаружены в Африке. Красными стрелками обозначено заражение вирусом гриппа от диких птиц к домашним и наоборот.Четвертый прогноз наиболее тревожный. Вирусом загрязнены многие водоемы в местах гнездовий и на путях пролета, и сохранится он там до весны. Каждый естественный водоем, куда попали фекалии зараженных птиц, превращается в “мину замедленного действия”. Это можно сравнить с вовлечением в таежный пожар торфяников. Весной зараженные и здоровые птицы вернутся обратно и полетят через эти “минные поля”, поэтому события летом 2006 г. могут быть значительно более грозными, чем в прошедшем сезоне. Подтверждение тому - уже в марте лавинообразное ухудшение ситуации в Европе, Азии и Африке. Это - уже панзоотия. А когда высокопатогенные штаммы, циркулирующие весной среди диких птиц, вернутся к слабопатогенным, сколько времени займет процесс их реассортации, предсказать невозможно - месяцы или годы. Ясно, что это предмет приоритетного изучения, от которого зависит развитие событий в обозримом будущем.Что касается пандемического вируса, то он может возникнуть и у нас после заражения свиней вирусами человека и птиц. Но скорее попадет к нам из Китая, где возможности трансформации реассортанта особенно велики, учитывая активность эпизоотического процесса и огромный восприимчивый контингент среди населения. Появиться у нас пандемический вирус может в любой момент - для этого достаточно лишь одной аминокислотной замены в РСС гемагглютинина, в результате вирус начнет распознавать рецепторы клеток человека и соответственно начнет передаваться от человека к человеку.
Что, с нашей точки зрения, следовало бы делать уже сейчас на государственном уровне, сформулировано в таблице. Мы же собираемся особое внимание уделить изучению дальнейшей эволюции высокопатогенных штаммов, поразивших популяции диких птиц. Ключевое значение в этом имеют экосистемы на территории России. Планируем продолжить мониторинг в европейской части страны, в Сибири и на Дальнем Востоке, а также, возможно, в некоторых сопредельных странах.
Хохлатая чернеть. Эта северная утка стала переносчиком вируса гриппа из цинхайско-новосибирской группы, вызвавшего в декабре 2005 г. вспышку гриппа в популяции лебедя-шипуна, обитающего в дельте Волги.Фото К.ван Ордена и Н.В.Паклиной В последние пять лет наши исследования проводились совместно с охотоведами, орнитологами, сотрудниками федеральных служб фитоветеринарного и санэпиднадзора Новосибирской, Астраханской, Иркутской областей, Приморского края, Биробиджана, республик Калмыкии и Бурятии. Все это проходило в рамках федеральных программ “Защита от патогенов”, “Разработка средств и методов противодействия биотерроризму”, “Грипп А свиней и птиц: взаимодействие популяций”.
Проведенные исследования мы рассматриваем как модельные при изучении чрезвычайных эпидемических ситуаций, возникших в результате действий природных факторов или криминальных событий. Для этой цели в Институте создана межлабораторная группа быстрого реагирования, способная по “конвейеру” быстро и надежно собрать полевые материалы и их обследовать комплексом классических и молекулярно-генетических методов с привлечением нанотехнологий (биочипов), разработанных нашими сотрудниками для определения генома вируса гриппа А и выявления его подтипов.
Литература
1. Lvov D.K. // Sov. Med. Rev. E. Virol. Rev. 1987. V.2. P.15-37.
2. Webster R.G., Bean W.J., German O.T. et al. // Microbiol. Rev. 1992. V.56. P.152-179.
3. Львов Д.К., Ильичев В.Д. Миграция птиц и перенос возбудителей инфекций. М., 1979.
4. Львов Д.К., Ямникова С.С., Забережный А.Д. и др. // Вопр. вирусол. 2005. №4. С.4-11.
5. Matrosovich M., Zhou N., Kawaoka Y., Webster R. // J. Virol. 1999. V.73. №2. P.1146-1155.
6. Suarez D.L., Senne D.A., Banks J. et al. // Emerg. Infect. Dis. 2004. V.10. №10. P.693-699.
7. Львов Д.К., Щелканов М.Ю., Дерябин П.Г. и др. // Вопр. вирусол. 2006. №1. С.11-14.
8. Львов Д.К., Прилипов А.Г., Щелканов М.Ю. и др. // Вопр. вирусол. 2006. №2. С.15-19.
9. Chen H., Smith G.J.D., Zhang S.Y. et al. // Nature. 2005. V.436. P.191-192.
10. Львов Д.К., Федякина И.Т., Щелканов М.Ю. и др. // Вопр. вирусол. 2006. №2. С.20-22.