№6, 2006 г.
© Леменовский Д.А., Брусова Г.П., Тимофеев В.В., Юрин С.А., Баграташвили В.Н., Попов В.К.
Вторая молодость известного явления
Д.А. Леменовский, Г.П. Брусова, В.В.Тимофеев,
С.А. Юрин, В.Н. Баграташвили, В.К. ПоповДмитрий Анатольевич Леменовский, д.х.н., проф., зав. лаб. координационных металлоорганических соединений химфака МГУ.
Галина Павловна Брусова, к.х.н., доц. каф. органической химии того же факультета.
Вадим Валентинович Тимофеев, к.х.н., с.н.с. каф. физической химии того же факультета.
Сергей Анатольевич Юрин, аспирант того же факультета.
Виктор Николаевич Баграташвили, д.ф.-м.н., проф., зав. лаб. Ин-та проблем лазерных и информационных технологий РАН.
Владимир Карпович Попов, к.ф.-м.н., с.н.с. того же института.Иногда бывает, что какое-либо научное открытие совершено, но остается невостребованным, о нем попросту забывают. К счастью, чаще открытое явление становится известным, его включают во все справочники и учебники, начинают использовать в практических целях. Но иногда применение сильно задерживается. Так случилось с четвертым агрегатным состоянием вещества - оно целых полтора столетия представляло только чисто научный интерес. Даже газовый закон Авогадро, не понятый современниками, ждал своего практического использования гораздо меньше - 50 лет.
Агрегатные состояния вещества
Еще в глубокой древности люди знали о трех агрегатных состояниях вещества - твердом, жидком и газообразном. С развитием науки стало понятно, что при изменении температуры или давления одно из состояний может переходить в другое, причем эти переходы, как правило, обратимы. Считается, что современный образованный человек имеет достаточные представления о самих состояниях и об их взаимных переходах. Однако существуют еще два агрегатных состояния - плазма и сверхкритические флюиды, находясь в которых вещества обладают специфическими свойствами и о которых большинство людей, кроме узких специалистов, мало что знает. Здесь речь пойдет о сверхкритических флюидах.
Впервые вещества в сверхкритическом состоянии наблюдал в 1822 г. французский физик Ш.Каньяр де ла Тур. Решив выяснить, происходит ли что-нибудь с жидкостями, нагреваемыми в наглухо закрытом металлическом шаре, он ввел в изучаемую среду простейший датчик - небольшой камешек. Нагревая и потряхивая шар, французский физик установил, что звук, издаваемый камешком при столкновении со стенкой шара, в некий момент резко меняется - становится глуше и заметно слабее. Для каждой жидкости такое изменение наступало при строго определенной температуре, которую стали именовать точкой Каньяра де ла Тура (сейчас в учебниках и справочниках эту точку называют критической). Однако что именно происходило с жидкостью в этой точке, некоторое время было неясно. К сожалению, сейчас почти никто не связывает имя Каньяра де ла Тура с важнейшим физическим явлением, которое он наблюдал в 1822 г. Но Каньяра де ла Тура все же знают мореплаватели по названию корабельной сирены, поскольку ее конструкцию предложил именно он. Видимо, биохимикам он тоже знаком как человек, первым предположивший (в 1836 г.), что при спиртовом брожении превращение сахаров в спирт и СО2 происходит с участием дрожжей.
Настоящий интерес к новому явлению возник лишь в 1869 г. после экспериментов ирландского физико-химика Т.Эндрюса, исследовавшего свойства СО2 при изменении температуры и давления. Этот газ легко сжижался при повышении давления, а поскольку опыты проводились в толстостенных стеклянных трубках, можно было видеть, что в них происходит. А происходило вот что: при 31°С и 73 атм граница (мениск), разделяющая жидкий и газообразный диоксид углерода, исчезала, весь объем равномерно заполнялся молочно-белой опалесцирующей жидкостью. Дальнейшее повышение температуры совершенно меняло картину - жидкость быстро становилась прозрачной и очень подвижной, в ней постоянно перетекали струи, напоминающие потоки теплого воздуха над нагретой поверхностью. Последующее повышение температуры и давления не вызывало видимых изменений. Точка, в которой происходит такой переход, была названа критической, а состояние вещества - сверхкритическим. По существу это новое агрегатное состояние вещества. Для него был предложен и используется до сих пор специальный термин - сверхкритический флюид (с англ. fluid - жидкость, жидкий, текучий), обозначаемое в литературе аббревиатурой СКФ.
Область существования сверхкритического флюида начинается в критической точке (рис.1), которая характеризуется температурой (Ткр), давлением (Ркр) и объемом Vкр.
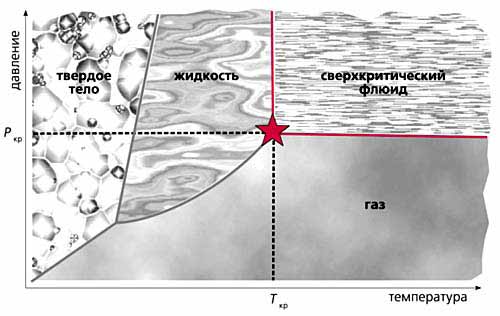
Рис.1. Фазовые переходы вещества в зависимости от температуры и давления.
Когда была выявлена критическая точка, стало понятно, почему некоторые газы, например водород, азот, кислород, долгое время не удавалось получить в жидком виде за счет повышения давления (из-за этого их долгое время называли перманентными газами). Поскольку область существования жидкой фазы расположена перед линией критической температуры (см. рис.1), для сжижения какого-либо газа его необходимо вначале охладить до температуры ниже критической. У таких газов, как СО2 или Сl2, критическая температура довольно высокая (31 и 144°С, соответственно), поэтому их можно сжижать при комнатной температуре, лишь повышая давление. Другое дело водород, кислород и азот с их низкими критическими температурами (соответственно: –239.9, –118.4, –147°С). Перед сжижением этих газов их необходимо вначале охладить до температуры ниже критической и только затем повышать давление. Итак, необходимость смещения от критической точки в сторону низких температур позволила решить ряд важных технологических задач, но исследования самого сверхкритического состояния долгое время находилось на периферии большой науки.
Постепенно изучение сверхкритических флюидов привело к обнаружению у них весьма необычного сочетания свойств: низкой плотности (к примеру, плотность воды в форме СКФ в три раза ниже, чем в обычных условиях), малой вязкости и низкой звукопроводности (последнее и помогло Каньяру де ла Туру обнаружить это явление). Кроме того, сверхкритические флюиды обладают высокой проникающей способностью (у них высок коэффициент диффузии). Установлено также, что флюиды представляют собой нечто среднее между жидкостью и газом. Они могут сжиматься как газы и, в то же время, подобно жидкостям способны растворять твердые вещества, причем их растворяющая способность резко возрастает при повышении давления.
Оказалось, что большинство жидких и газообразных веществ может находиться в сверхкритическом состоянии, важно лишь, чтобы вещество не разлагалось при критической температуре. К середине 80-х годов 20-го столетия справочники содержали сведения о критических параметрах сотен неорганических и органических веществ, но все еще не было ясно, как можно применить столь удивительные свойства СКФ.
“Сверхкритический” бум
С конца 80-х годов ХХ в., когда общий уровень развития индустрии позволил создавать установки, работающие под высоким давлением, началось триумфальное шествие сверхкритических технологий. Лидером среди флюидов стал СО2, поскольку он обладает целым комплексом преимуществ: сравнительно легко переводится в сверхкритическое состояние (напомним: 31°С и 73 атм), доступен, дешев, нетоксичен, негорюч, экологически безопасен и хорошо растворяет большой спектр органических соединений.
Неудивительно поэтому, что химики-технологи стали внедрять СКФ в практику. Основное направление, которое начало бурно развиваться, - это экстракция. По сравнению с традиционными методами, предусматривающими применение обычных растворителей, возможности, которые дает использование флюидов, просто ошеломляют. Например, для извлечения из кофейных зерен кофеина, применяемого в фармакологии, их без предварительного измельчения, прямо в мешках, помещают в автоклав, подают в него газообразный СО2, создают необходимое для возникновения флюида давление и через некоторое время сливают сверхкритический диоксид углерода в открытую емкость. В ней, при атмосферном давлении, СО2 превращается в газ, а экстрагированный кофеин остается в чистом виде. О такой экстракции химики-технологи могли только мечтать! Все это результат сочетания исключительной растворяющей способности и высокого коэффициента диффузии СКФ.
Фармацевтическая промышленность первой обратилась к технологии, в которой используются сверхкритические флюиды. И это вполне объяснимо, поскольку с их помощью удается наиболее полно выделять из растительных и животных продуктов эфирные масла, витамины, алкалоиды, фитонциды, сохраняя неизменным состав извлекаемых веществ и не привнося в него примесей. Очень простой стала стадия отгонки экстрагирующего растворителя и последующая его очистка для повторных циклов. Появились даже фирмы, специализирующиеся на производстве витаминов, стероидов и других препаратов только по новой технологии.
Применение СКФ оказалось весьма успешным для очистки от загрязнений электронных схем в процессе их производства, так как на них не остается никаких следов очищающего растворителя. Сейчас разрабатываются проекты установок для химической чистки одежды с использованием сверхкритических флюидов.
С помощью СКФ можно эффективно освобождать полимеры от примесей непрореагировавшего мономера и инициатора полимеризации. Кроме того, флюиды незаменимы для введения в массу полимера красителей, стабилизаторов, а также различных модификаторов.
При всеобщем лавинообразном увлечении экстракцией химики не забыли о своих “синтетических” интересах - использовать СКФ в качестве реакционной среды. Прежде всего исследователей привлекла исключительная способность сверхкритических флюидов растворять газы. Например, для водорода и азота, растворяемых в таких средах, удается достичь концентраций в 10-20 раз более высоких, чем в обычных растворителях. Первыми синтезами, осуществленными в сверхкритических средах, стали процессы гидрирования (рис.2). Опубликованные в литературе результаты по каталитическому гидрированию органических соединений (см. рис.2,а,б) в сверхкритическом СО2, свидетельствуют о необычайно высокой эффективности новой методики: существенно снизилась температура процесса, резко возросла скорость реакции, а в некоторых случаях проявилась отчетливая селективность - затрагивались только определенные двойные связи (см. рис.2,б). Разработан также эффективный способ каталитического гидрирования в сверхкритическом СО2, приводящий к образованию муравьиной кислоты (рис.2,в).
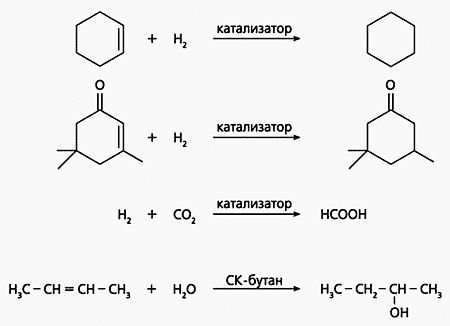
Рис.2. Примеры некоторых органических реакций, осуществленных в сверхкритических средах.
Помимо гидрирования осуществлены и доведены до промышленного внедрения некоторые другие процессы, например, получение бутанола-2 присоединением воды к бутену-2 в сверхкритическом бутане (рис.2,г).
Иная среда - иные продукты реакции
Мы тоже использовали сверхкритические среды и сначала сосредоточили внимание на таких процессах органического синтеза, которые ранее в СК-средах не проводились. Конкретной целью нашей работы стали реакции окисления органических соединений озоном в среде сверхкритического углекислого газа.
Озон как самостоятельное соединение известен человечеству с 1840 г. Этот газ используют сейчас во многих промышленных процессах, однако как избирательно действующий реагент озон до сих пор не применяется. На пути его использования в органическом синтезе все время стоит чрезмерная реакционная способность и плохая управляемость его реакций.
Мы решили экспериментально проверить, пригоден ли озон в качестве окислителя с управляемой реакционной способностью для синтезов в СК-средах. Подобные эксперименты до наших исследований никогда не проводились. Единственный окислительный процесс в сверхкритическом CO2, серьезно изученный до нас, это синтез алкеноксидов, которые образуются из алкенов за счет окисления молекулярным кислородом в присутствии металлсодержащих катализаторов.
Для выполнения любых синтезов в сверхкритической среде обычная лабораторная техника неприменима, поэтому мы сконструировали специальную установку. Она представляла собой реактор объемом около 100 см3, рассчитанный на рабочее давление вплоть до 200 атм и оснащенный системой устройств, позволяющих дозировать реагенты и управлять протекающей реакцией.
Продукты реакции мы изучали традиционными спектральными методами, которые обычно применяют химики-синтетики: ЯМР, ИК- и УФ- спектроскопией, масс-спектрометрией, а также хроматомасс-спектрометрией.
Вначале мы исследовали несложные органические системы и уже на таком простом соединении, как димер циклопентадиена (он обычно образуется при хранении циклопентадиена; рис.3,а,б), обнаружили отчетливое различие при переходе от обычных органических растворителей к сверхкритическому СО2. Димер интересен тем, что содержит две неэквивалентные двойные связи, каждая из которых потенциально способна окисляться.
При проведении реакции в обычном растворителе - хлороформе (метанол был введен в качестве сореагента) - окисление озоном идет с образованием диальдегида (см. рис.3,в), причем затрагивается только одна двойная связь. В сверхкритическом СО2 окислению подвергается как та же связь, так и другая. В результате образуются совсем иные продукты: монометиловые эфиры дикарбоновых кислот (см. рис.3,г,д), причем каждое из этих соединений представляет собой смесь изомеров, у которых гидрокси- и метоксигруппы меняются местами. Судя по соотношению продуктов, в сверхкритическом СО2 реакционноспособной оказывается и та двойная связь димера, которая в обычных условиях почти не реагирует.
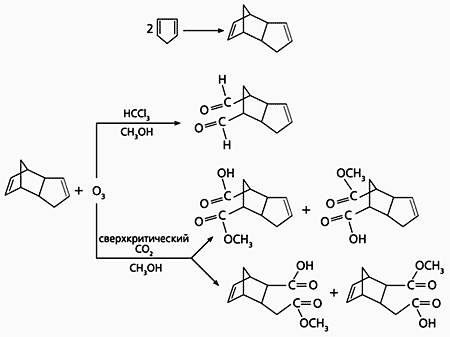
Рис.3. Окисление диолефина в обычном растворителе и в сверхкритическом CO2.
Реакционная система обгоняет фантазию экспериментатора
На следующем этапе мы выбрали в качестве объекта о-изопропениланилин - ароматическое соединение, содержащее олефиновый фрагмент (группу с двойной связью) и аминогруппу (рис.4). Поскольку эти группы заметно различаются свойствами, мы хотели узнать, какая из них более подвержена окислению. Естеcтвенно, мы провели одну и ту же реакцию, меняя только реакционную среду, чтобы оценить то своеобразие, которое вносит сверхкритический СО2. К этому времени мы уже понимали, что переход к необычной реакционной среде таит в себе сюрпризы, однако оригинальность и неожиданность полученных результатов превзошли все, что мог заранее предположить химик-синтетик.
Если в среде обычных органических растворителей озон окислял только двойную связь в изопропенильной группе, переводя ее в кетонную (см. рис.4,а), то в сверхкритическом СО2 направление реакции менялось принципиально: изопропенильная группа оказалась незатронутой, в реакции участвовала только аминогруппа (см. рис.4,б). До проведения экспериментов можно было бы с определенной долей уверенности предполагать, что аминогруппа окислится до нитрогруппы –NO2, но образование изоцианатной группы –N=C=O оказалось совершенно неожиданным. Оригинальность реакции заключалась в том, что среда - сверхкритический углекислый газ - участвует во взаимодействии, он служит источником фрагмента –С=О в изоцианатной группе.
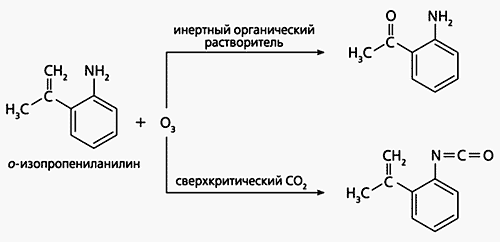
Рис.4. Окисление о-изопропениланилина в обычном растворителе и в сверхкритическом СО2.
Этот эксперимент весьма привлекателен, потому что открывает неизвестный ранее путь получения ароматических изоцианатов, причем в исключительно мягких условиях (традиционный способ их получения фосгенированием аминов экологически небезопасен и осуществляется при 170-180°С). Интерес к этому процессу продиктован тем, что ароматические изоцианаты представляют собой очень ценный продукт современной химической промышленности, и любой новый способ их синтеза сразу становится объектом внимательного изучения со стороны технологов. Сейчас мы продолжаем обширные исследования в этом направлении и надеемся, что удастся существенно увеличить эффективность и значительно упростить методику таких превращений.
Повышаем концентрацию озона
Проводя эксперименты, мы заметили, что сверхкритические технологии таят в себе еще одну интересную возможность. Здесь уже упоминалось, что СК-среды обладают высочайшей способностью растворять газы. А это совпадает с естественным желанием каждого химика-синтетика повысить концентрацию реагентов, чтобы ускорить реакцию. Однако озон - реагент особый, в отличие от водорода, используемого для гидрирования, он крайне нестабилен и при повышении концентрации легко диспропорционирует по общей схеме:
2О3 ® 3О2
Например, если замороженный до твердого состояния озон постепенно нагреть выше точки плавления (Тпл = 80.6 К), произойдет взрыв из-за энергично протекающего разложения по цепному механизму. Вследствие нестабильности озона не удается достичь его высокой концентрации ни в газовой фазе, ни в органических растворителях.
Нам удалось установить, что использование сверхкритического CO2 позволяет варьировать концентрацию озона в широком диапазоне, изменяя его парциальное давление в системе. Чтобы определить предельные концентрации озона в сверхкритическом CO2, оценить границы стабильности этого окислителя и очертить ту область, в которой можно безопасно с ним экспериментировать, мы спроектировали и изготовили из кварца специальную оптическую ячейку переменного объема, рассчитанную на высокие давления. В такой кварцевой ячейке мы спектрально контролировали изменение концентрации озона, растворенного в сверхкритическом CO2 (в УФ-спектре озон дает интенсивную полосу поглощения в диапазоне 200-300 нм).
Таким способом нам удалось изучить кинетику разложения озона в интервале температур 298-324 К. Оказалось, что сверхкритический CO2 эффективно тормозит процесс разложения O3: вероятность соударений двух молекул озона, приводящих к распаду, резко снижается, поскольку основная доля приходится на соударения молекул O3 и CO2. Интересно, что с ростом давления СO2 скорость термического разложения озона падает. Благодаря этому удается получить недостижимую ранее парциальную концентрацию озона, что позволяет ощутимо интенсифицировать окислительную реакцию.
Основное ощущение, которое у нас постепенно сложилось в процессе этой работы, таково: сверхкритические технологии не только расширяют возможности синтетической химии, но и в буквальном смысле открывают новые неизвестные ранее горизонты - реакции, протекающие в сверхкритических условиях, часто не имеют ничего общего с реакциями в обычных условиях.
Другие флюиды
Должны заметить, что, несмотря на неоспоримое лидерство CO2 в мире сверхкритических технологий, постепенно начинают входить в практику некоторые другие флюиды. Сверхкритический ксенон (tкр = 16.6°С, pкр = 58 атм) представляет собой абсолютно инертный растворитель, и потому химиков он привлекает как реакционная среда для получения нестабильных соединений (чаще всего металлоорганических), для которых СО2 служит потенциальным реагентом. Однако ксенон весьма дорогой газ, и потому его широкого применения вряд ли стоит ожидать.
Для извлечения животных жиров и растительных масел из природного сырья более подходит сверхкритический пропан (tкр = 96.8°С, pкр = 42 атм), поскольку он лучше растворяет указанные соединения, нежели СК-СО2. Но и пропан не лишен недостатков - он легко воспламеняется, к тому же критическая температура его сравнительно высока.
Одно из самых распространенных и экологически безвредных веществ - вода, но перевести ее в сверхкритическое состояние довольно трудно, так как параметры критической точки очень велики: tкр = 374°С, pкр = 220 атм. Современные технологии позволяют создавать установки, отвечающие таким требованиям, но работать в этих диапазонах температуры и давления все же сложно. Зато сверхкритическая вода растворяет почти все органические соединения (которые не разлагаются при указанной температуре). При добавлении в нее кислорода вода становится мощнейшей окислительной средой: любые органические соединения за несколько минут превращаются в Н2О и СО2. В настоящее время химики исследуют возможность перерабатывать таким способом бытовые отходы, прежде всего - пластиковую тару, например, бутылки из-под газированных напитков. Сжигание такой тары неприемлемо, ведь при этом возникают токсичные летучие вещества. В будущем намечено разработать установки для уничтожения запасов химического оружия с помощью сверхкритической воды.
Несмотря на неоспоримые достоинства современных сверхкритических технологий, они все же обладают (с точки зрения химиков-синтетиков) одним недостатком - для перехода в состояние флюида необходимы десятки атмосфер. Однако следует принять во внимание, что далеко не все возможности исчерпаны. Химиками получены и исследованы миллионы соединений. Не затерялось ли среди них какое-то вещество, которое в сверхкритическом состоянии будет обладать такими свойствами, что сумеет затмить все известные на сегодня флюиды? Но не исключено, что это будет совсем новое, никому пока не известное соединение.
В заключение подчеркнем, что все обсуждения мы вели с позиции сравнения сверхкритических сред с жидкими и газообразными. Так же и с технологиями. Исследователи, используя уже осознанные преимущества СК-сред, пока пытаются приспособить и перенести в них те технологические процессы, которые сейчас осуществляются в газообразной и жидкой средах. Это естественная стадия в становлении любой новой отрасли. Однако положение меняется очень быстро, уже формируются полноценные и совершенно оригинальные СК-технологии, не имеющие ничего общего с тем, что привычно сегодня. И эти технологии начинают давать новые вещества и материалы, недоступные для традиционных производств. Такие, например, как наноразмерные материалы для электроники и оптики, новые лекарственные формы и материалы медицинского назначения.
Кроме того, эти необычные технологии отвечают требованиям “зеленой химии”. Той химии, которая как по способу производства, так и по результату не вредит окружающей среде. Имеется в виду, прежде всего, миниатюризация производств, безотходность технологий, сбережение ресурсов и энергии.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проекты: 03-02-16662, 03-03-32566, 04-02-16933).