№ 7, 2000 г.
№ 7, 2000 г.
© Т.В.БейерКлетка в клетке,
или
“бомба” замедленного действияТ.В.Бейер
Тамара Владимировна Бейер, доктор биологических наук, профессор,
ведущий научный сотрудник лаборатории цитологии одноклеточных организмов
Института цитологии РАН.Когда в новой компании меня спрашивают, чем я занимаюсь, отвечаю, что я биолог-цитолог, а к упоминанию о паразитах стараюсь подходить постепенно и несколько издалека. И это понятно — в современный лексикон слово “паразит” вошло с весьма негативным смыслом. А потому есть разница в том, чтО сказать: “занимаюсь ядерной физикой” или “изучаю паразитов”. И все же я рада, что всю свою жизнь в науке посвятила всестороннему изучению паразитов, от гельминтов (в студенческие годы в Ленинградском университете) до простейших (в Институте цитологии РАН), поскольку, раскрывая тайны этих существ и удивляясь их умению контактировать с заключающей их клеткой или тканью, я постигала одновременно и секреты общения между людьми в коллективе.
Паразитизм — широко распространенное биологическое явление, с которым все без исключения живые существа так или иначе сталкиваются в ходе эволюции. Паразитарные инфекции вызывают не только экзотические для нас, северян, болезни; возбудители многих из них существуют бок о бок с нами, и каждый может ими заразиться в любой момент, часто даже не заметив. В первую очередь это относится к наиболее специализированным внутриклеточным паразитам (“клетка в клетке”): вирусам, бактериям, грибам, простейшим и даже гельминтам. Наша небольшая научная группа уже много лет занимается изучением паразитических простейших — кокцидий (Coccidiida) — ближайших родственников малярийных паразитов рода Plasmodium.
Как известно, при паразитизме один организм (хозяин) служит средой обитания для другого (паразита). Обитание внутри клетки ставит паразита в строгую экологическую и метаболическую зависимость от хозяина, хотя от такого союза в первую очередь страдает хозяин. В результате создается система паразита и хозяина, в которой вследствие отбора устанавливается более или менее устойчивое равновесие между партнерами. Однако человеку в качестве хозяина в этом отношении повезло меньше, чем животным. Как справедливо отмечает С.А.Беэр, человек, ввиду своей относительной эволюционной молодости, не успел еще образовать ни с одним из паразитических организмов равновесной системы, и все паразиты для него оказываются патогенными, хотя и в разной степени [1].
К сожалению, человеку очень не повезло еще раз, и это стало особенно очевидным в последние десятилетия ХХ в., с приходом на планету вируса иммунодефицита человека (ВИЧ) и связанного с ним страшного недуга — синдрома приобретенного иммунодефицита (СПИД). Сегодня ВИЧ-инфекция по-прежнему считается абсолютно смертельной. Но было замечено, что больные умирают от СПИДа неодинаково, т.е. от разных вторичных инфекций. Оказалось, что снижение иммунной защиты макроорганизма стимулирует реактивацию многих патогенных организмов, которые раньше, до наступления иммунодефицита, находились в организме человека в скрытом состоянии и внешне никак себя не проявляли. Такие инфекции называются условно-патогенными, или оппортунистическими (от англ. opportunity — возможность), и во многих случаях вызываются внутриклеточными паразитами. Справедливо отмечено, что до тех пор, пока не будет побежден вирус иммунодефицита человека, надежда на продление жизни больных со СПИДом будет зависеть в первую очередь от успехов медицины в борьбе с оппортунистическими болезнями [2]. Вот и пришло время вирусологам, бактериологам и протозоологам объединить усилия в борьбе со СПИДом.
Более трех четвертей всех летальных исходов при СПИДе происходит по вине оппортунистических инфекций, некоторые из них квалифицируются даже как СПИД-маркерные болезни. Наибольшее значение среди возбудителей этих инфекций принадлежит протисту Pneumocystis carinii — аскомицетному грибу, вызывающему интерстициальную пневмонию со значительным числом летальных исходов. По сравнению с вирусными и бактериальными возбудителями паразитические простейшие в этом отношении изучены еще крайне мало.
Так что же такое оппортунистические инфекции? По общепринятому определению, это — инфекции, вызываемые условно-патогенными микробами, заражение которыми у здорового (иммунокомпетентного) субъекта не сопровождается патологическими явлениями, а при угнетении иммунной системы вызывает заболевания [3]. Такую характеристику вряд ли можно назвать исчерпывающей, поскольку в ней не разъясняется специфика оппортунистического патогена. Еще в 1937 г. А.А.Филиппченко заметил [4], что нельзя определять один объект (паразита) по признаку, исключительно принадлежащему другому объекту (хозяину). В нашем же случае иммунодефицит проявляется как раз у хозяина, а не у паразита.
Этот постулат во многом стимулировал наш интерес к биологической сущности оппортунистических патогенов, а также к тем механизмам, с помощью которых одни из них могут воспользоваться иммунодефицитным состоянием хозяина, а другие — нет. Заметим, что поиск адекватного определения условно-патогенных и патогенных инфекций ведется уже давно и особенно активно медицинскими паразитологами [5], с которыми мы все же расходимся в оценке категории “биологических свойств” возбудителей. Для наших медицинских коллег это — в первую очередь патогенность возбудителя, для нас — его жизненный цикл. Сравнив жизненные циклы кокцидий, мы были поражены тем, что из великого множества этих патогенов к категории оппортунистических (согласно определению) можно отнести лишь считанные единицы возбудителей— Toxoplasma gondii, Isospora belli, Cryptosporidium parvum, Cyclospora sp.
Для разрешения всех вопросов нам нужны были как минимум две экспериментальные модели: оппортунистического и неоппортунистического патогенов. Однако нельзя было начинать работу, не имея собственной рабочей гипотезы. И в этом плане нам повезло, поскольку к началу исследований у коллектива был свой достаточно серьезный научный задел по изучению биологии кишечных кокцидий рода Eimeria (неоппортунистического патогена) и паразита органов и тканей позвоночных животных — токсоплазмы T.gondii (оппортунистического). Полная расшифровка циклов развития токсоплазмы, как, впрочем, и других цистообразующих кокцидий (Sarcocystis, Frenkelia), была сделана в начале 70-х годов текущего столетия [6]. В частности, было показано, что их жизненные циклы включают двух хозяев — промежуточного и окончательного. В те годы мне посчастливилось работать в Институте серологии в Копенгагене, где удалось получить дополнительные данные в пользу кокцидийной природы T.gondii. Впоследствии результаты этих работ и более ранних исследований по видам рода Eimeria были обобщены в монографии [7].
Позднее, уже в 90-е годы, сопоставление данных по биологии разных родов эймериидных кокцидий позволило нам сформулировать основные постулаты рабочей гипотезы. В жизненном цикле оппортунистического патогена должны присутствовать персистирующие (покоящиеся) стадии, обладающие непременно бесполыми потенциями. Такие стадии заключены внутри защитных образований (цист), позволяющих ему выживать в организме хозяина с нормальной иммунной системой в течение длительного времени. Обычно это происходит в иммунологически привилегированных органах и тканях (головном мозге, мышцах), куда почти не проникают антитела. В условиях же иммунодефицита, когда в крови хозяина количество лимфоцитов Т-4 снижается (до 200 в одном микролитре), только покоящиеся бесполые стадии паразита способны к бесконтрольному размножению в организме зараженного хозяина.
Важно понимать, что заражение хозяина и приобретение им иммунодефицита — два разных события, разделенных во времени и пространстве. Так, человек может быть инфицирован T.gondii в детстве, а приобрести иммунодефицит — в зрелые годы, и именно тогда произойдет реактивация тех тканевых цист, которые долгие годы благополучно сохранялись в головном мозге и других органах. Получается, что человек, однажды заразившийся оппортунистическим патогеном, фактически никогда с ним не расстается и всю жизнь как бы сидит на неразорвавшейся бомбе, роль которой играют латентные (скрытые) стадии патогена. Разрыв “бомбы” (реактивация спящего паразита) может произойти спустя многие годы, например при СПИДе, в результате чего у больного развивается обширный энцефалит, и мозговые нарушения обычно оказываются необратимыми.
Приступить к проверке нашей гипотезы мы смогли в 1995—1997 гг. На этот раз в качестве модели неоппортунистического патогена были взяты кокцидии рода Sarcocystis, которые подобно T.gondii также формируют цисты в промежуточном хозяине, но только не в мозге, а в мышечной ткани. В ходе сравнительного изучения ультраструктуры и метаболизма этих возбудителей нам удалось выявить принципиальные различия в персистировании внутри цист T.gondii и Sarcocystis [8]. Цисты токсоплазмы включают клетки только одного морфо-функционального типа, тогда как цистные стадии саркоспоридий представлены по крайней мере тремя разными типами клеток. Но главное различие состоит не в количестве стадий, а в их качественном разнообразии.
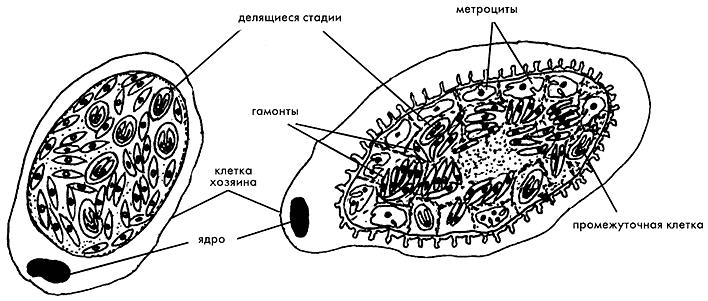
Схематическое изображение тканевых цист Toxoplasma gondii (с л е в а) и Sarcocystis spp.
Оценивая развитие изучаемых паразитов, мы пришли к заключению, что все цистные клетки T.gondii (брадизоиты) — бесполые, медленно развивающиеся (пролиферирующие) стадии. В условиях иммунодефицита тканевые цисты нередко разрушаются, при этом происходит обратное развитие (конверсия) брадизоитов в предцистные быстро пролиферирующие клетки (тахизоиты). По существу это и есть реактивация латентной инфекции. С этого момента развитие паразита больше не сдерживается клеточным иммунитетом, а развивающиеся тахизоиты не испытывают губительного воздействия цитокинов (g-интерферона или фактора некроза опухолей). Бурное бесконтрольное размножение паразитов приводит к обширному поражению головного мозга и органа зрения. В цистах Sarcocystis развитие паразита, напротив, идет необратимо и только в одном направлении: от бесполых, способных к пролиферации, метроцитов и промежуточных клеток к высоко дифференцированным предполовым клеткам — гамонтам, утратившим способность к делению. Старые гамонты своевременно удаляются из популяции цист в результате естественной гибели клеток и тем самым исключаются из дальнейшего участия в половом процессе в окончательном хозяине. Этим можно объяснить наличие пустот в центре зрелых саркоцист, в которых гамонты составляют свыше 95% всех цистных клеток. В условиях иммунодефицита, даже в случае выхода из разрушенных саркоцист, гамонты Sarcocystis, в отличие от цистных стадий T.gondii, не смогут приступить к размножению в том же хозяине.
Главное различие в развитии токсоплазмы и саркоспоридий в фазе персистирования, по нашему мнению, позволяет понять и разницу в течении инфекционного процесса при токсоплазмозе и саркоцистозе в организме хозяина с ослабленным иммунитетом. Соотношение процессов пролиферации и дифференцировки в жизненных циклах патогенов и определяет способность токсоплазмы (или неспособность саркоспоридий) использовать в своем развитии возможность, предоставляемую иммунодефицитным состоянием хозяина.
В качестве модели оппортунистического патогена при кишечном паразитизме мы выбрали кокцидий рода Cryptosporidium, в жизненном цикле которых в отличие от T.gondii и Sarcocystis и подобно кишечным кокцидиям рода Eimeria участвует только один хозяин. Эти паразиты вызывают у больного изнурительную профузную диарею, которая сопровождается резким обезвоживанием организма и даже гибелью. От этой инфекции чаще всего погибают телята первых дней жизни, а для человека она опасна только при СПИДе.
Кроме того, поражает удивительная особенность Cryptosporidium — способность локализоваться в энтероцитах кишечника хозяина экстрацитоплазматически, что затрудняет или даже исключает воздействие на паразита защитных механизмов клетки хозяина (лизосомального переваривания или окислительного взрыва). Со стороны просвета кишки паразит надежно защищен двумя мембранами паразитофорной вакуоли и тремя мембранами собственной пелликулы. Последнее обстоятельство отчасти объясняет исключительную устойчивость криптоспоридий к лекарствам (криптоспоридиоз пока не лечится!).
Цисты Toxoplasma gondii на срезе головного мозга мыши. (Окраска на полисахариды.) Перечисленные биологические особенности, конечно же, значительно отличают криптоспоридий от других кишечных кокцидий, но вряд ли объясняют оппортунистическую природу этого патогена, поскольку ни одна из них не ассоциируется с его возможным персистированием. И только благодаря более глубокому изучению полного жизненного цикла С.раrvum у криптоспоридий удалось обнаружить наличие феномена персистирования, но особого рода. В отличие от большинства других кишечных кокцидий, ооцисты криптоспоридий полностью спорулируют и становятся инвазионными (способными заражать) не во внешней среде, а в организме хозяина. Часть ооцист не выделяется наружу, а остается в хозяине, но неизвестно, в каких именно органах и тканях. Ясно одно — местом сохранения ооцист не могут быть энтероциты кишечника.
Схематическое изображение жизненных циклов кишечных кокцидий рода Eimeria (слева) и Cryptosporidium. Цветными стрелками показано направление развития.По данным электронномикроскопических исследований Н.В.Свежовой, ооцисты C.parvum сохраняют структурную целостность даже внутри фагосом клеток иммунной системы зараженных крыс — макрофагов, лимфоцитов, эозинофилов, нейтрофилов [9]. Способность фагоцитов захватывать патоген в просвете кишечника продемонстрировала новую сторону отношений между паразитом и хозяином при криптоспоридиозе. Еще больший интерес представляет вызванное этим паразитом формирование на апикальной поверхности макрофагов характерной экстрацитоплазматической паразитофорной вакуоли, внутри которой протекают эндогенные стадии.Eimeria: 1 — спорозоит; 2—4 — мерогония 1-й генерации; 5 — мерозоит 1-й генерации; 6—8 — мерогония 2-й генерации; 9 — мерогония n-й генерации; 10—12 — микрогаметогенез; 13, 14 — макрогаметогенез; 15 — микрогаметы; 16—18 — неспорулированные ооцисты; 19 — спорулированные ооцисты во внешней среде.
Cryptosporidium: 1 — спорозоит; 2—4 — мерогония 1-й генерации; 4а — мерозоит 1-й генерации; 5—7 — мерогония 2-й генерации; 7а — мерозоит 2-й генерации; 8, 9 — микрогаметогенез; 10, 11 — макрогаметогенез; 12 — оплодотворение; 13 — образование зиготы; 14, 15 — спорулированные ооцисты внутри клетки; 14а, 14б — ооцисты, сохраняющиеся в организме хозяина; 16 — спорулированные ооцисты вне клетки и во внешней среде.
Наши исследования находятся еще на начальном этапе. Но уже и сейчас с определенной долей уверенности можно говорить о возможности длительного переживания (персистирования) криптоспоридий в организме хозяина, что происходит благодаря их способности развиваться не только в кишечнике, но и вне кишечника — в макрофагах, а может быть и в других клетках иммунной системы макроорганизма. При иммунодефиците бесполые эндогенные стадии паразита высвобождаются из таких клеток и немедленно приступают к бесконтрольному размножению в кишечнике. Это во многом облегчается благодаря известной способности 1-й генерации мерозоитов Cryptosporidium к рециклированию, приводящему к многократному умножению числа бесполых стадий той же генерации (сходный механизм рециклирования известен еще только у T. gondii в кишечнике кошки). Тем самым объясняется обширная паразитарная колонизация криптоспоридиями кишечника и других органов у хозяина с ослабленным иммунитетом.
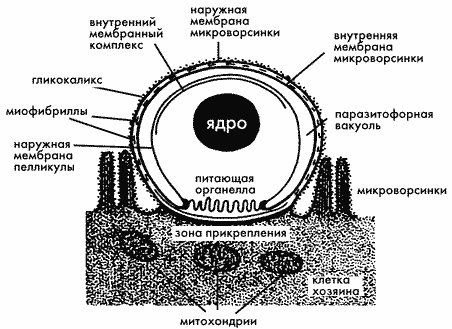
Схема экстрацитоплазматической локализации стадий развития Cryptosporidium parvum в энтероцитах кишечника мыши (Braendler, 1982).
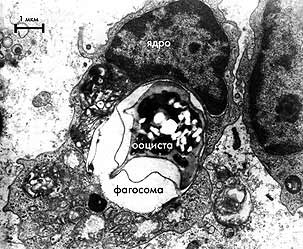
Электронная микрофотография ооцисты Cryptosporidium parvum
внутри фагосомы макрофага крысы (Свежова Н.В., 1997).
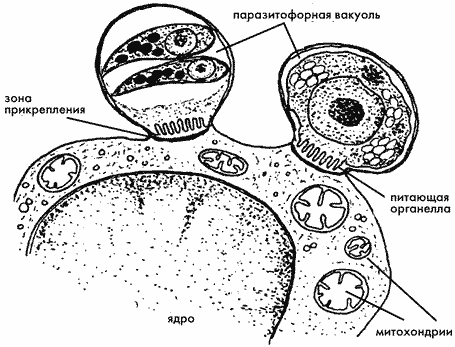
Схема экстрацитоплазматической локализации Cryptosporidium parvum
в макрофаге крысы (Свежова Н.В., 1997).* * *
Итак, при изучении внутриклеточных паразитов (кокцидий) нам удалось провести границу между оппортунистическими и неоппортунистическими патогенами на основании выявления различий в соотношении процессов пролиферации и дифференцировки в их жизненных циклах. Если стадии, способные к персистированию, сохраняют функции бесполых клеток, то при снятии иммунного надзора они смогут приступить к бесконтрольному размножению в хозяине, в результате чего начнется развитие инфекционного процесса. Если латентными стадиями оказываются дифференцированные клетки, то они не способны к дальнейшей пролиферации в том же хозяине даже при СПИДе.
Мы остановились лишь на двух оппортунистических протозойных патогенах — T.gondii и C.parvum. Ясно, что проблема таких патогенов и вызываемых ими болезней значительно шире. По мнению А.Я.Лысенко, эта проблема заслуживает включения в приоритетную федеральную научно-практическую программу, в которой должны участвовать специалисты разных профилей — паразитологи, цитологи, иммунологи, инфекционисты, патологи. На фоне все более и более устрашающих сведений о размахе ВИЧ-инфицированности в нашей стране эти слова должны восприниматься не только как мудрое пожелание, но и как призыв к немедленному действию.
Работа выполнена при поддержке Российского фонда фундаментальных исследований. Грант 95-04-11068.
Литература
1 Беэр С.А. Паразитизм // Природа. 1996. №12. С.19—26.
2 Mills J., Mazur H. // Scientific American. 1990. V.263. N2. P.50—57.
3 Редфилд Р.Р., Берке Д.С. // В мире науки. 1988. №12. С.60—69.
4 Филиппченко А.А. // Учен. зап. ЛГУ. Сер. биол. 1937. Т.4. С.4—14.
5 Фролов А.Ф., Зарицкий А.М., Фельдман Ю.М. // Журн. микробиол. 1986. №9. С.93—97; Лысенко А.Я. // Мед. паразитол. и паразит. болезни. 1994. №4. С.3—8.
6 Hutchison W.M., Dunachie J.F., Siim J.Chr., Work K. // Brit. Med. J. 1970. V.1. P.142—144; Frenkel J.P., Dubey J.P., Miller N.L. // Science. 1970. V.164. P.893—896; Fayer R. // Science. 1972. V.175. P.65—67.
7 Бейер Т.В., Шибалова Т.А., Костенко Л.А. Цитология кокцидий. Л., 1978.
8 Beyer T.V., Radchenko A.I. // Protozool. Abstrs. 1995. V.19. №10. P.645—649; Radchenko A.I., Beyer T.V. // Ibid. P.651—657.