№7, 2004 г.
© Галактионов В.Г.
ПРОИСХОЖДЕНИЕ СПЕЦИФИЧЕСКИХ ИММУНОГЛОБУЛИНОВ
В.Г. Галактионов
Вадим Гелеевич Галактионов, доктор биологических наук,
профессор кафедры иммунологии Российской медицинской академии постдипломного образования,
ведущий научный сотрудник Института биологии развития им.Н.К.Кольцова РАН.Хорошо известно, что в ответ на проникновение в организм патогенов (бактерий, вирусов, простейших и других возбудителей инфекций) среди прочего образуются антитела - наиболее эффективные защитники человека и животных от нежелательных визитеров. С легкой руки австралийского иммунолога, лауреата Нобелевской премии (1960) М.Ф.Бернета их стали называть иммуноглобулинами, подчеркивая тем самым прямое отношение к иммунной системе организма. Основное свойство таких белков - специфичность по отношению к проникшему в организм инфекционному агенту, т.е. иммуноглобулины, образующиеся к возбудителю А, нейтрализуют только его, но инертны к любым другим инфекционным агентам В, С, D и т.д. Именно это свойство иммуноглобулинов было и в определенной степени остается до сих пор самым интригующим для иммунологов. С чем связана столь выраженная специфичность? Как в организме возникают такие иммуноглобулины? Как природа создала механизм специфичности? Вот те вопросы, на которые исследователи искали и продолжают искать ответы.
Строение иммуноглобулинов
До середины 50-х годов прошлого столетия о структурной организации иммуноглобулинов ничего не знали. Первый шаг в этом направлении сделал английский иммунохимик Р.Портер в 1959 г. Он показал, что при обработке очищенных иммуноглобулинов протеолитическими ферментами образуются три фрагмента, два из которых взаимодействуют с антигеном (патогеном) и потому названы антигенсвязывающими (Fab), и один, неспособный к такому взаимодействию (Fc).
Но это ничего не говорило о причинах их специфичности по отношению к разным антигенам. Для получения информации о молекулярных основах вариабельности нужно было значительное количество полностью идентичных белков. Сывороточные иммуноглобулины, в массе образующиеся после иммунизации, не давали такой возможности, поскольку они - производные нескольких клеточных клонов, каждый из которых продуцирует белки только одного класса и только одной, свойственной ему, специфичности. Иначе говоря, иммуноглобулины, выделяемые от интактных или иммунизированных животных, есть смесь молекул с разной специфичностью и разной принадлежностью к тому или иному классу.
Необходима была экспериментальная модель, позволяющая работать с одним клоном, образующим иммуноглобулины только одной специфичности и только одного класса. Природа предоставила такую возможность - злокачественно трансформированные плазматические клетки больных миеломой. В настоящее время существует большой набор клонированных плазмоцитом человека и животных, продуцирующих соответствующие миеломные белки.
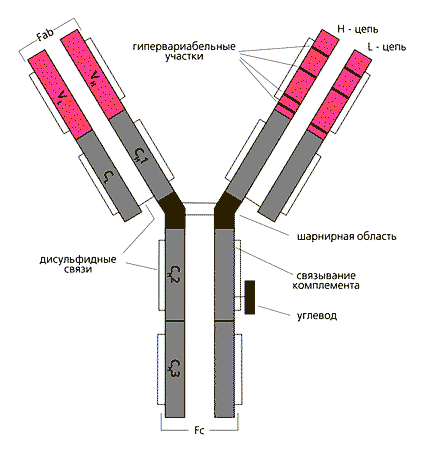
Рис.1. Строение иммуноглобулина G.
Две тяжелые (Н) цепи с мол. весом 50 кД и две легкие (L) с мол. весом 25 кД объединены в единую молекулу с помощью ковалентных дисульфидных связей. Каждая цепь содержит вариабельную область (VL и VH для L- и H-цепей соответственно) и константную (С), подразделяющуюся у Н-цепей на гомологичные участки (домены): CH1, CH2, CН3. L-цепь имеет один константный участок - CL. От взаимодействия VH- и VL-областей зависит специфичность иммуноглобулинов как антител. В аминокислотной последовательности V-доменов имеются гипервариабельные участки, характеризующиеся частой заменой аминокислот от белка к белку, и более консервативные. Между СН1 и СН2 доменами Н-цепи находится шарнирная область, обеспечивающая подвижность антигенсвязывающего Fab-фрагмента. СН2-домен служит местом присоединения углеводов и связывания комплемента. СН3-домен взаимодействует с Fc-рецептором (не способным связывать антиген) на поверхности клеток, принимающих участие в иммунологических реакциях.Изучение аминокислотной последовательности иммуноглобулинов выявило принципиальные особенности в их строении. Каждая полипептидная цепь включает несколько доменов, гомологичных участков: тяжелая цепь - четыре или пять в зависимости от принадлежности к определенному классу и легкая цепь - два домена (рис.1). Первые домены изменчивы от белка к белку, все остальные - константны и у иммуноглобулинов одного класса представлены теми же самыми аминокислотами. Ясно, что специфичность иммуноглобулинов как антител связана с вариабельными доменами. Собственно активный центр - участок, реагирующий с антигеном, образуется при взаимодействии вариабельных доменов тяжелой и легкой цепей (рис.2), обеспечивающих специфичность иммуноглобулинов.
Рис.2. Схема взаимодействия антигенсвязывающей области (активного центра) иммуноглобулина с антигеном - витамином К1. Реконструкция на основании данных рентгеноструктурного анализа. V-домены легкой и тяжелой цепей (VL и VH) образуют полость (глубина 0.5-0.6 нм, длина 1.6 нм и ширина 0.7 нм), с которой связывается витамин (показан цветом). Как правило, параметры полости других иммуноглобулинов больше отмеченных здесь величин.
Гены иммуноглобулинов
Наличие вариабельной и константной областей в структуре иммуноглобулинов молекулы позволило американским исследователям Дрейеру и Беннету еще в 1965 г. предположить, что в построении единой тяжелой или легкой цепей молекулы участвуют два гена (V и C). Это “еретическое” для середины 60-х годов суждение, когда еще господствовало мнение, выражающееся формулой “один ген - одна полипептидная цепь”, нашло свое подтверждение в несколько измененном виде в настоящее время.
В незрелых В-клетках, продуцентах иммуноглобулинов, или в любых других соматических клетках V- и С-гены расположены на одной и той же хромосоме, но на значительном расстоянии друг от друга. Подобная локализация определяется как состояние зародышевой линии. Однако по мере созревания В-клеток (от предшественника к зрелым формам) пространственно удаленные генные сегменты оказываются в непосредственной близости друг от друга, образуя единый информационный участок. Такая перестройка генетического материала, названная соматической рекомбинацией, происходит только в соматических клетках (в случае с иммуноглобулиновыми генами только в В-клетках) и потому не наследуется.
Синтез тяжелых цепей иммуноглобулина контролируется тремя типами генных сегментов для V-доменов: V, D и J и десятью (по числу классов и подклассов иммуноглобулинов) сегментами для С-области соответствующих иммуноглобулинов (рис.3). Всего известно около 500 V-генных сегментов, 15 D-сегментов и четыре J-сегмента. Контроль синтеза легких цепей зависит от работы 250 V-генов, четырех J-генных сегментов и С-гена для константной части полипептида.
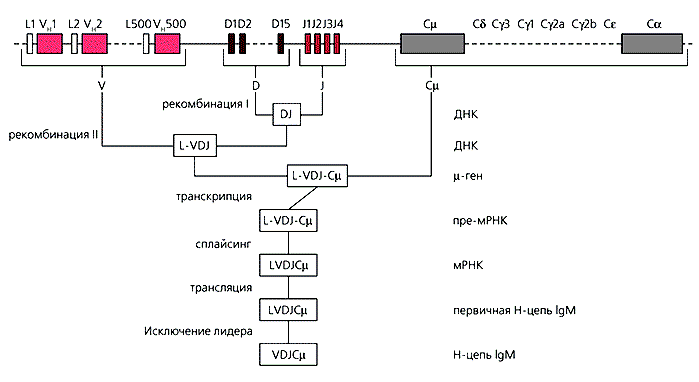
Рис.3. Рекомбинация генов, кодирующих тяжелые цепи иммуноглобулинов (V, D, J и C).Первое событие - объединение одного из 15 D-мини-генов с одним из 4 J-мини-генов; второе - объединение одного из 500 VH-генов с DJ; третье - формирование VDJ-Cm-локуса. Образующаяся при транскрипции с этого локуса пре-мРНК вступает в процесс созревания - сплайсинга. Особенность реорганизации генома В-клеток состоит в переключении контроля синтеза иммуноглобулинов одного класса на другой при сохранении контроля специфичности за счет реорганизованного VDJ-локуса.Изучение хромосомной организации иммуноглобулиновых генов и этапов их реорганизации в процессе развития В-клеток позволило достаточно точно установить первопричину вариабельности иммуноглобулинов. Ее основу составляет случайное объединение друг с другом отдельных генных сегментов в результате рекомбинации: V, D, J - для тяжелых цепей и V, J - для легких цепей иммуноглобулинов. При образовании единого информационного участка изменчивость для V-домена тяжелых цепей составит 30 тыс. (500V ґ 15D ґ 4J). Учитывая возможные нарушения при рекомбинации, связанные с включением пограничных нуклеотидов справа и слева от D- и J-сегментов, это число следует умножить на четыре. Тогда количество вариантов V-доменов для тяжелых цепей иммуноглобулинов будет 120 тыс., а для легких цепей уже 2 тыс. (250V ґ 4J ґ 2). Так как конкретная молекула иммуноглобулинов строится при случайном сочетании тяжелых и легких цепей, общее число вариантов антигенсвязующих центров, следовательно, и специфических иммуноглобулинов, составит 2.4·108 (рис.4). Однако, по мнению некоторых исследователей, в связи с дополнительными, не отмеченными здесь, рекомбинационными событиями она доходит до 1012-1014.
Рис.4. Схема случайных, разнообразных сочетаний генных сегментов, контролирующих VH-домены тяжелых цепей иммуноглобулинов.Поскольку В-клетки одного клона продуцируют иммуноглобулины только одной конкретной специфичности, то по отношению к В-клеточной популяции в целом полученные цифры указывают на число таких клонов. Они образуют множество специфических иммуноглобулинов, способных взаимодействовать с соответствующим количеством антигенов. Ясно, что подобный порядок величин обеспечивает организму в условиях физиологической нормы защиту от последствий самых разнообразных антигенных (патогенных) вторжений.В результате неконтролируемой рекомбинации этих сегментов возможно образование до 30 тыс. вариантов специфических антител. Величина выведена без учета дополнительной изменчивости в результате нарушений при рекомбинации, связанных с включением пограничных нуклеотидов справа и слева от D- и J-мини-генов. С учетом этих нарушений число вариантов тяжелых цепей увеличивается до 120 тыс. Аналогичные расчеты касаются и генов для VL. Общая вариабельность как результат взаимодействия VH с VL - 1.2·105ґ2·103 = 2.4·108.
Эволюция иммуноглобулинов
Среди проблем современной иммунологии вопрос об историческом развитии иммуноглобулинов - один из основных. Он напрямую связан с пониманием биологических явлений, которые привели к возникновению и совершенствованию системы иммунологического распознавания - начального этапа нейтрализации и уничтожения патогенных микроорганизмов. Сегодня очевидно, что спектр вариабельности различных классов иммуноглобулинов, характерный для млекопитающих, имеет длительную предысторию, корнями уходящую к одноклеточным животным. Проникновение в самую отдаленную глубину времен стало возможным благодаря технологическим возможностям молекулярной биологии и генетики.
Исследования 80-х годов показали, что иммуноглобулины не одиноки в организме животных. Они лишь члены достаточно большой группы, включающей более 50 самостоятельных белков, подобных иммуноглобулинам, но обладающих не только иммунологической функцией. Группа получила название суперсемейства иммуноглобулинов, для которых характерны два свойства: статистически значимая гомология с иммуноглобулинами в последовательности аминокислот и особая, свойственная только им, структурная организация доменов (рис.5), обозначаемая как Ig-fold (иммуноглобулиновая складчатость).
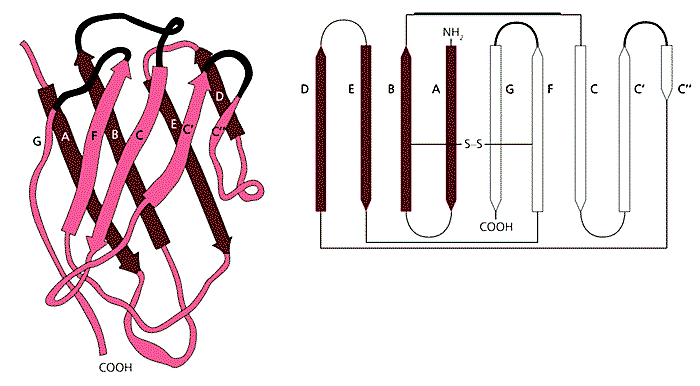
Рис.5. Структурная организация V-домена.Слева - диаграмма кристаллографического анализа V-домена тяжелой цепи иммуноглобулина человека, демонстрирующая характер двухслойной складчатости (Ig-fold). Справа - связи между b-структурными слоями и a-спиралями; черный цвет - гипервариабельные участки. (Адаптировано из: Barclay A.N., 1999.)Всего выделяют четыре основных типа доменов: V1, V2, С1 и С2. Хотя по своей структуре они схожи, но функционально отличаются друг от друга. Для нас наиболее интересны V-домены, поскольку именно они и сформировали способность к специфическому распознаванию чужеродного биологического материала, в первую очередь патогенных микроорганизмов.V1-домены могут взаимодействовать с чужеродными молекулярными структурами (антигенами). Гены, ответственные за их образование, включают как собственно V-ген, так и два мини-гена - D и J. От их реорганизации в процессе созревания В-клеток и зависит специфичность V1-доменов, взаимодействие с различным структурно меняющимся биологическим материалом, антигенами. Контакт V1-доменов с чужеродными соединениями получил название гетерофильного взаимодействия, т.е. “своего” с “чужим”.
V2-домены самостоятельно или в составе каких-либо белков могут взаимодействовать между собой по принципу “свое” со “своим” - V2“V2 (гомофильное взаимодействие). Ген, контролирующий этот домен, представляет собой единый информационный участок.
Основной вопрос эволюционной иммунологии как раз и состоит в том, чтобы понять, когда, как и зачем гомофильное взаимодействие сменилось на гетерофильное, т.е. нереорганизуемый V-ген стал реорганизуемым. Другими словами, что обеспечило эволюцию предковых V-доменов до современных форм, способных реагировать с множеством антигенов (патогенов).
Наиболее ранние обладатели иммуноглобулиновой складчатости (структуры Ig-fold) - прокариоты (бактерии эшерихии, клебсиеллы, др.). У этих бактерий данный домен выполняет функцию шаперона - низкомолекулярного белка, участвующего в построении адгезивных молекул (рис.6). Белок нервной ткани (Р0), маркер тимоцитов и Т-клеток (Thy-1), входящие в V2-группу, также относятся к ранним эволюционным образованиям. Полипептиды, родственные белку Thy-1 млекопитающих, обнаружены у птиц, рептилий, рыб, дождевых червей, туникат, головоногих и брюхоногих моллюсков, одноклеточных эу- и прокариот. Функция Thy-1 точно не определена. Возможно, его появление в филогенезе связано с возникновением многоклеточных около 2 млрд лет назад. Тогда благодаря контактному взаимодействию “своего” со “своим” он выступал как один из поверхностных молекулярных факторов межклеточной адгезии.
Пример наиболее раннего тандемного события в исторической ретроспективе - гены губок, наиболее примитивных многоклеточных животных, которые контролируют два белка: адгезивный SAM и рецепторную тирозинкиназу RTK. У этих белков два поверхностных V-домена гомологичны V-доменам иммуноглобулинов человека. Сегодня известно около 40 полигенных копий данных белков. Экспрессия RTK и SAM усиливается при ауто- и аллотрансплантации. Эти факты крайне важны для возникновения первых признаков специфического иммунитета в мире животных. К категории двухдоменных белков, включающих V2-домены, относятся также рецепторы кортикальных тимоцитов (субпопуляций клеток тимуса) лягушек (СТХ), кур (ChT1), человека (СТН) и др. (рис.7). Вся группа белков, подобных иммуноглобулинам, способна лишь к гомофильному взаимодействию. Должно было произойти важное эволюционное событие, чтобы возникло основное свойство классических иммуноглобулинов - взаимодействие с чужеродным антигеном.
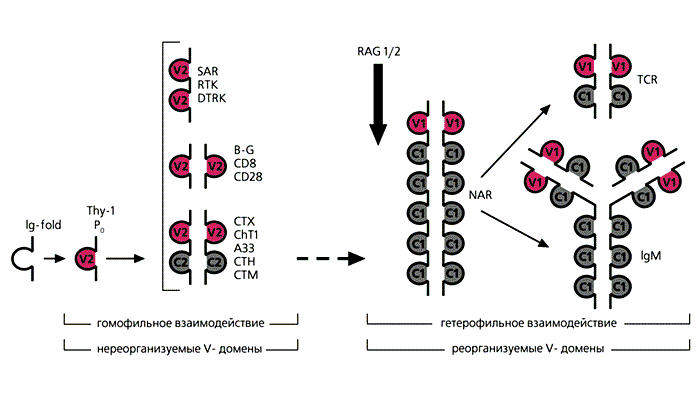
Рис.7. Филогенез иммуноглобулинподобных молекул.Слева - однодоменный шаперон прокариот с структурой Ig-fold и два однодоменных белка Р0 и Thy-1. Эти белки были предковыми для целой серии двухдоменных белков (SAP - адгезивный белок губок, PTR - рецепторная тирозинкиназа губок, DTRK - рецепторная тирозинкиназа дрозофилы, B-G - поверхностный антиген кур, CD8 - корецептор цитотоксических Т-клеток млекопитающих, CD28 - рецептор, принимающий участие в инициации иммунного ответа, CTX, ChT1, CTH, CTM - соответственно рецепторы кортикальных тимоцитов лягушек, кур, человека, мыши). RAG-1 и -2 - гены, обеспечивающие рекомбинацию, определили эволюционное развитие членов суперсемейства по антигенспецифическому пути развития. Предшественником Т-клеточного антигенраспознающего рецептора (ТКР) и иммуноглобулина М (IgM) был новый антигенный рецептор акул (NAR).Предполагается, что главный виновник формирования специфических иммуноглобулинов - ретровирус, который в отдаленные геологические времена внедрился в единый V-геном предков позвоночных животных (около 450 млн лет назад). Подобное событие привело к расщеплению V-гена на собственно V-ген и D- и J-сегменты. Геномные участки, оказавшись самостоятельными, подвергались обычным генетическим процессам - в первую очередь тандемным дупликациям и случайным мутациям. В результате возникло множество V-генов (у млекопитающих их более 500).Вторая важная функция генов состоит в обеспечении синтеза рекомбиназ (RAG-1, RAG-2) - ферментов, участвующих в реорганизации V-, D-, J-генных сегментов. Случайность их объединения определяет множественность синтезируемых V-доменов. Для тяжелых иммуноглобулинов только за счет рекомбинации образуется около 1.2·105 вариантов. Ясно, что появление в эволюции механизма рекомбинации V-генов было прогрессивным событием.
При анализе представленного здесь филогенетического ряда необходимо ответить на некоторые, не вдруг решаемые вопросы. Например, с чем связан переход от гомофильных форм взаимодействия к гетерофильным, что его вызвало и привело в результате к созданию столь уникальной системы распознавания в виде клоно- и антигенспецифических Ig и ТКР*.
Думается, что первым и наиболее важным событием было эволюционное возникновение Ig-fold доменов, подобных шаперонам современных прокариот. Для таких доменов, сыгравших столь значимую роль в эволюции антигенраспознающих рецепторов, характерно наличие аминокислотных петель, соединяющих b-структурные последовательности. Именно в них происходили аминокислотные замены, поставлявшие для отбора сырой материал в виде структурно меняющихся V-доменов.
Первоначальная функция Ig-fold доменов - участие в межклеточных гомофильных взаимодействиях. Эту роль в эволюции могли выполнять предшественники однодоменных, а затем и двухдоменных V-подобных белков Thy-1, P0, SAP, RTK, DTRC. Их появление в эволюции не случайно. Они стояли у истоков возникновения многоклеточных, обеспечивая межклеточную адгезию посредством гомофильного взаимодействия.
Первичные многоклеточные животные (впрочем, как и современные), находясь в тех или иных биоценотических условиях, неизбежно подвергались агрессии патогенов внешней среды от вирусов до паразитических многоклеточных. В этом нет ничего неожиданного, и современная жизнь различных видов животных дает тому бесчисленное множество примеров. Важно другое. Первичные V-гены с повышенной изменчивостью обеспечивали синтез варьирующих по специфичности V-доменов. Некоторые из них случайным образом взаимодействовали с антигенами патогенов. Если патогенетическое действие внешнего агента снижалось, а устойчивость особей вида повышалась, то ген, контролирующий измененный домен, благодаря сильному давлению отбора закреплялся в популяции вида. Такие отношения между первичными многоклеточными и патогенами привели к переключению гомофильного взаимодействия на гетерофильное, действующее по принципу рецептор-лиганд. Со временем количество мутационно измененных V-генов увеличилось. Выраженная полигения V-генов у современных челюстноротых позвоночных животных тому прямое подтверждение.
Случайные мутации и отбор как определяющие факторы в эволюции антигенраспознающих рецепторов были сопряжены с рядом дополнительных явлений. К ним относится: самостоятельное развитие генов для С-доменов; их объединения с V-генами в единый локус, число которых росло из-за тандемных дупликаций; появление дополнительных D- и J-генных сегментов, расширяющих пределы изменчивости V-доменов благодаря рекомбинации с основными V-генами. Все эти процессы были крайне важны для формирования молекулярной системы антигенного распознавания, окончательный вариант которой представлен у млекопитающих. Они составили основу для действия RAG-1 и RAG-2 генов, которые и определили переход от гомофильного взаимодействия к антигенспецифическому гетерофильному. Интродукция ретровирусных генов в геном позвоночных была столь существенна для создания специфического иммунитета, что получила название “большого взрыва”.
Зачем конкретному индивидууму такой большой запас реорганизуемых V-генов, если в жизни он встречается с ограниченным числом антигенов и большинство V-генов оказывается бесполезным? Ответ на этот вопрос лежит в двух плоскостях. Во-первых, мы не знаем, с каким истинным многообразием антигенов входит в контакт конкретный организм в течение жизни. Помимо традиционных бактериальных, вирусных, грибковых антигенов, возможны антигенные нагрузки, связанные с мутационно измененными собственными клетками. Во-вторых, для жизнедеятельности вида, его стабильности не столь важно, проявляется или нет тот или иной признак у конкретной особи, но существенно присутствие генов, контролирующих данный признак, если он адаптивен. Гены, обладающие неограниченным свободным скрещиванием, - достояние всей популяции и вида в целом, т.е. входят в состав его генофонда. * * *
Общие положения, сформулированные при анализе видообразования, самым тесным образом связаны с пониманием значения избыточного пула иммунологической специфичности для вида. Антигенраспознающие рецепторы или иммуноглобулины, невостребованные у какой-либо особи вида в течение ее индивидуальной жизни, могут оказаться необходимыми другой особи данной популяции или особям иных генераций той же популяции. В целом же уровень специфичностей иммуноглобулинов, имеющийся у высших позвоночных животных, создает необходимый запас прочности для стабильной жизнедеятельности вида.