№ 8, 2000 г.
№ 8, 2000 г.
О.В. Михайлов
Олег Васильевич Михайлов, доктор
химических наук,
профессор Казанского государственного
технологического университета.
Вместо пролога
Читавшие “Звездные дневники Ийона Тихого” С.Лема, видимо, помнят путешествие четырнадцатое их одноименного героя на некую планету Энтеропию, где обитают сверхгигантские животные — курдли. На них разумные существа сей планеты — ардриты — охотятся... изнутри. Этот способ охоты невольно приходит на ум, когда речь заходит о химических процессах, протекающих при контакте желатиновых матричных систем с водными растворами хелатообразующих лигандов. Образованию комплексов металла с лигандом в этих необычных условиях и посвящена данная статья. Вначале, как полагается, следует
Введение
Одно из новейших направлений современной координационной химии — комплексообразование в массиве природного полимера желатина, в котором предварительно иммобилизованы металлсодержащие соединения. В таких системах исходные вещества и продукты реакции с той или иной степенью жесткости удерживаются в полимерной матрице. В принципе допустимы два варианта подобного закрепления: посредством функциональных групп полимера либо за счет межмолекулярных сил. В первом — необходимо наличие у полимера структурных фрагментов, способных химически связывать ион металла; тип же образующихся связей металла с полимером зависит от природы реагирующих компонентов. Второй вариант наряду с формированием подобных химических связей предусматривает еще и закрепление вещества в полимере вследствие дисперсионного, ориентационного, индукционного и аналогичного им взаимодействий. Возможен и третий случай, когда закрепление достигается благодаря действию лишь упомянутых физических сил и не сопровождается образованием химических связей металла с полимером. Такой вариант можно реализовать посредством как сугубо физико-механических (напылением, адсорбцией, импрегнированием), так и физико-химических (осаждением вещества в полимере) операций [1].
Системы первого и второго типов, равно как и комплексообразование в них, в настоящее время уже весьма хорошо изучены, им посвящен целый ряд монографий и обзорных статей. Системы же третьего типа вплоть до начала наших исследований выглядели этакими “пасынками” в мире иммобилизованных металлокомплексов и внимания исследователей не привлекали. Почему? Может, потому, что в свое время просто не удалось найти подходящих полимеров для комплексообразования? А может, и потому, что исследователи не видели принципиальной разницы между образованием комплексов в матрицах и в растворе (или твердой фазе)? Автор этих строк взялся за перо, чтобы проиллюстрировать богатые синтетические возможности подобных иммобилизованных систем (пусть и — пока — на сравнительно небольшом количестве объектов с одним-единственным полимерным массивом), каковыми являются
Матрицы из желатина
с иммобилизованными металлгексацианоферратами(II)Почему именно желатин представляет особый интерес для создания иммобилизованных систем, в которых вещество закрепляется межмолекулярными силами и благодаря этому могут образовываться металлокомплексы? Ведь как природных, так и синтетических полимерных систем, в принципе пригодных для “физического закрепления” вещества, предостаточно — от декстрана до полиэтилентерефталата. Но в том-то и дело, что именно желатин обладает всеми необходимыми качествами (изотропностью физико-механических свойств, гидрофильностью, прозрачностью, стойкостью к действию кислых и щелочных растворов, пластичностью), необходимыми для образования гетероядерных комплексов или хелатов при контакте матрицы, в которой уже иммобилизован металлокомлекс, с водным раствором лиганда (неорганического или органического вещества, образующего координационное соединение с ионом другого металла). Наконец, этот полимер дешев, легкодоступен и удобен в обращении. Тем не менее до начала наших работ системы с желатином как объект исследования в координационной химии вообще не использовались. Причина? Сейчас трудно сказать, но, видимо, не в последнюю очередь та, что традиционные методы иммобилизации просто не позволяли получать матричные системы с молекулярным уровнем дисперсности металлокомплексов. (Подобное достижение на первый взгляд сравнимо с ювелирной работой легендарного тульского левши, подковавшего блоху, или — в современном варианте — изготовившего электромотор размером с маковое зернышко.)
Автору этих строк повезло — ему удалось найти комплексы, довольно легко иммобилизуемые в желатиновом массиве. Ими оказались гексацианоферраты(II) p-, d- и f-элементов, у которых с жесткостью фиксации в желатине удачно сочетаются оптимальная кинетическая лабильность, стабильность и весьма низкая растворимость в воде. Внешне схема их иммобилизации весьма проста, хотя сам синтез всей системы — специфический и довольно трудоемкий процесс. Удобный исходный объект для ее осуществления — желатиновая матрица с иммобилизованным галогенидом серебра, а это не что иное, как светочувствительные слои современных фотоматериалов. Степень дисперсности галогенида в них отнюдь не молекулярная, но галогенид можно легко превратить в Ag (для этого используются давно и хорошо известные в фотографической практике процессы экспонирования — “засветки”, — проявления и фиксирования), и тогда размеры частиц иммобилизованного вещества уже сопоставимы с размерами крупных кластеров. А уж дальше посредством серии специфических химических реакций иммобилизованное в желатиновой матрице серебро можно заместить очень широким ассортиментом металлокомплексов вообще и гексацианоферратов(II), в частности, сохранив при этом — что очень важно — уже достигнутый молекулярный уровень дисперсности частиц. В результате в желатине окажутся иммобилизованными металлгексацианоферраты (МГФ). Проще всего такую систему получить в три стадии. На первой — содержащееся в матрице серебро окисляется гексацианоферратом(III) калия в Ag4[Fe(CN)6]:
{4Ag} + 4K3[Fe(CN)6] ® {Ag4[Fe(CN)6]} + 3K4[Fe(CN)6]
(в фигурных скобках— формулы иммобилизованных соединений). На второй — образовавшийся гексацианоферрат(II) серебра взаимодействует с галогенидом того или иного металла, например кобальта:
{Ag4[Fe(CN)6]} + 2CoCl2 ® {Co2[Fe(CN)6]+4AgCl}.
И наконец, на третьей — галогенид серебра удаляется из системы под действием раствора тиосульфата натрия:
{Co2[Fe(CN)6]+4AgCl} + 8Na2S2O3 ® {Co2[Fe(CN)6]} + 4Na3[Ag(S2O3)2] + 4NaCl.
В ряде случаев можно получить подобные системы с иммобилизованным металлгексацианоферратом(II) и более коротким путем — в две стадии. На первой — иммобилизуемый комплекс осаждается вкупе с гексацианоферратом(II) или галогенидом серебра, на второй — соединения серебра удаляются из желатинового массива опять-таки тиосульфатом [2].
Как известно, молекулы желатина состоят из трех полипептидных цепей — двух a1 и одной a2 — с почти одинаковой молекулярной массой. Цепи эти соединены меж собой ограниченным числом поперечных связей, и неудивительно, что желатиновые массивы по своей эластичности напоминают резину. Такая структура не допускает формирования жестких кристаллических блоков и удобна для создания матричных систем, так как имеет множество ячеек, куда при подходящих условиях могут “забраться” молекулы самых разных соединений. Даже будучи заполненными ими, такие ячейки сохраняют определенную свободу перемещения в пространстве. Вот почему на основе этого полимера можно получить матричные системы с практически однородным распределением иммобилизованного вещества. Перечень ценных для нас свойств желатина этим не ограничивается, но сейчас важно другое. “Просвечивание” матриц с иммобилизованным веществом потоком электронов показало, что все они прозрачны по отношению к нему. А это значит, что содержащиеся гексацианоферраты(II) металлов и в самом деле имеют молекулярный уровень дисперсности. В соответствии со своими структурами в твердой фазе они являют собой координационные полимеры с относительно небольшой молекулярной массой и занимают пустоты между молекулами желатина. У атомов железа и другого металла, например кобальта, находящихся близко к граничной поверхности этих структур, всегда имеются вакантные координационные места.
Схема строения желатиновой матрицы с иммобилизованным металл- гексацианоферратом(II). Этот комплекс может насчитывать от единиц до нескольких десятков молекул M2[Fe(CN)6] и зажат между участками молекул желатина, каждая из которых состоит из переплетенных между собой полипептидных цепей - a1 и a2.
Совокупность данных о желатине как полимерном массиве позволяет выделить следующие специфические особенности комплексообразования в системе желатин—металлгексацианоферрат(II):- затрудненный, по сравнению с раствором, контакт между реагентами;В этой связи желатиновую матрицу с МГФ, с одной стороны, можно рассматривать как твердофазный реакционный микрообъем, с другой — как некое промежуточное состояние между раствором и твердой фазой. “Лобовая атака” МГФ лигандом, пока последний не находится в водно-щелочном растворе, не приводит к успеху — гексацианоферрат(II) металла надежно защищен от него желатиновой “броней”. Другое дело при контакте того же металлокомплекса со щелочными растворами хелатирующих лигандов. Их депротонированные формы образуют более устойчивые по сравнению с МГФ координационные соединения, и лиганды, диффундируя в желатиновый слой, “атакуют” находящийся в нем МГФ изнутри. Получается как в охоте на упомянутого курдля, когда охотник, прежде чем проникнуть внутрь этого чудища, предварительно смазывает себя специальной смесью. А уж далее лиганд, добравшись до металла М, связывает его в соответствующее хелатное соединение. Входящее же в состав МГФ двухвалентное железо трансформируется в кинетически инертный анион [Fe(CN)6]4–, который потом удаляется из полимерной фазы в раствор. Возможен, впрочем, и другой вариант. Вначале МГФ разрушается под действием ионов ОН–, которые содержатся в контактирующем с матрицей растворе, а уж потом возникший на его “развалинах” другой координационный полимер — оксогидроксид соответствующего металла — вступает в комплексообразование с наличным лигандом.- наличие заряда у молекул полимерного массива (поскольку желатин — амфолит);
- крайне малый объем, где образуется комплекс;
- ограниченная подвижность комплексообразователя (в данном случае — иммобилизованного МГФ) при достаточно высокой подвижности молекул взаимодействующего с ним лиганда;
- малая скорость “доставки” лиганда в реакционный объем.
Теперь настало время хотя бы кратко охарактеризовать
Выбор цели
Не секрет, что исследователи в области координационной химии не обращали сколько-нибудь серьезного внимания на потенциальные возможности металлокомплексных желатиновых систем и не смогли не только реализовать в них комплексообразование, но и хотя бы просто получить их. Скептицизм остается и ныне. В этой связи в исследовании по гранту у нас были две задачи:
- выявить синтетические возможности нашей системы в процессах “классического” комплексообразования (по схеме: ион металла + органический лиганд, содержащий N,P,O,S, ® комплекс) и темплатного синтеза (ион металла + фрагменты того же лиганда ® комплекс), протекающих при контакте МГФ, иммобилизованных в желатине, со щелочными растворами органических соединений;
- собрать доказательства того, что в подобных экзотических условиях могут формироваться такие хелатные соединения, которые либо вообще невозможно синтезировать в растворе или твердой фазе, либо удается получить лишь в более жестких условиях (например, при повышенной температуре).
C учетом отмеченных уже специфических особенностей комплексообразования в нашей системе можно было прогнозировать преимущественное формирование в полимерном массиве следующих типов координационных соединений, нехарактерных для синтеза в растворе или твердой фазе: промежуточных комплексных форм; координационных димеров и полимеров; лигандо- и протонодефицитных хелатов. Золотая жила, которую — копать и копать! Но рамки статьи позволяют, к сожалению, продемонстрировать лишь наиболее яркие моменты этих “раскопок”. Посмотрим вначале, что может дать нам
“Классическое” комплексообразование в МГФ-матрице
Без сомнения, самое резкое отличие этого процесса от образования координационных соединений в растворе (или твердой фазе) наблюдается в системе ион металла—лиганд, где металл — это, скажем, двухвалентный никель, а лиганд L — дитиооксамид H2N-C(=S)-C(=S)-NH2. Результаты анализа кинетических кривых комплексообразования, химического анализа и традиционных физических методов исследования свидетельствуют, что если этот процесс протекает в желатиновой матрице с иммобилизованным МГФ, то синтезируются минимум пять (!) координационных соединений, причем разного цвета. В стилизованной форме их можно записать как (Ni2L)2[Fe(CN)6] (зеленовато-серый), NiL(OH2)2 (розово-фиолетовый), [NiL(OH2)2]n (фиолетовый), [Ni(HL)2]n (темно-синий) и [NiLHL]– (бесцветный), где HL– и L2– — одно- и двукратно депротонированная форма лиганда дитиооксамида. Примечательно, что NiL((OH2)2 при pH<5 быстро и необратимо переходит в [Ni(HL)2]n. Если эту же реакцию комплексообразования проводить в растворе или твердой фазе, образуется лишь одно координационное соединение [3] — [Ni(HL)2]n.
Откуда это резкое различие? А дело в том, что теоретически возможны два варианта атаки дитиооксамидом имеющихся у иммобилизованного в желатине Ni2[Fe(CN)6] вакантных координационных мест — либо сразу двух, принадлежащих разным атомам никеля, либо только одного. Первый из них, который как раз и должен привести к образованию комплекса с дефицитом лиганда, может воплотиться только в жестко ограниченном реакционном объеме и недостатке лиганда в нем. В принципе для комплексообразования в растворе и твердой фазе можно создать или то, или другое условие, а вот одновременно оба — лишь в желатиновой системе. Если же в этой системе реализуется второй вариант, из-за ее крайне малого реакционного объема создаются очень высокие концентрации ионов OH–. Это способствует “атаке” ими вакантных “аксиальных” координационных мест образующегося в первый момент интермедиата Ni(HL)2 с последующим присоединением одной молекулы лиганда и формированием протонодефицитного хелата NiL(OH2)2. При достаточно большой концентрации последнего в желатиновой системе он агрегирует и образуется полимер [NiL(OH2)2]n — опять-таки благодаря крайне малому реакционному объему.
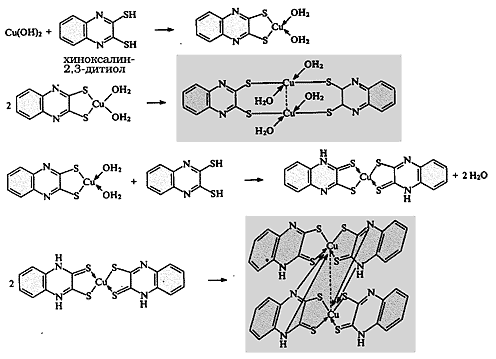
Синтез димерных хелатов из ионов меди и хиноксалин-2,3-дитиола в МГФ-матрице.
Реакция образования хелатов
из ионов кобальта (III) и
меркаптохинолина в МГФ-матрице.
R: H, SH или SCH3.Характерно, что из этих же соединений, если реакция протекает не в матрице, а в растворе или твердой фазе, образуется лишь по одному хелатному комплексу. Но все это меркнет по сравнению с тем, что способен обеспечить
Темплатный синтез
Комплексообразование в желатиновой системе, по сравнению с таковым в растворе или твердой фазе, имеет еще большие преимущества в темплатном синтезе (т.е. из фрагментов), во всяком случае в одном из его вариантов, сопровождающемся внутримолекулярной дегидратацией. Крайне малый реакционный объем, в котором происходит комплексообразование, и протонодонорная способность желатина обеспечивают как большее сближение молекул реагирующих веществ и их избирательную ориентацию по отношению друг к другу, так и повышение подвижности протонов в молекулах образующихся промежуточных комплексов. Первым примером такого синтеза было взаимодействие иона металла (Ni,Cu) с дитиооксамидом и формальдегидом, протекающее с образованием темно-коричневых макроциклических хелатов. Позднее выяснилось, что в качестве металла может быть использован и кобальт (причем в этом случае темплатный синтез сопровождается переходом Co(II) ® Co(III)), формальдегид заменен на глиоксаль, ацетальдегид или ацетон, а дитиооксамид — на тиосемикарбазид. Замечательно, что темплатный синтез с использованием указанных органических соединений в растворе или твердой фазе требует как минимум повышенной (60°С) температуры, тогда как в МГФ-системе для него хватает и комнатной [4].
Темплатный синтез макроциклических хелатов в МГФ-матрице.
В темплатном синтезе сделаны пока лишь первые шаги. Однако и полученных данных вполне достаточно для того, чтобы с уверенностью говорить о его богатейших потенциальных синтетических возможностях в подобных специфических условиях, в частности, для получения гетероядерных макрокомплексов.
Ну, а в заключение скажем
Для чего пригодны МГФ-системы
Прикладные аспекты комплексообразования в них вытекают непосредственно из свойств самих этих матриц. Во-первых, их можно использовать для измерения спектров поглощения иммобилизованных в них комплексов, поскольку все полученные нами металлокомплексные желатиновые системы оптически изотропны, а содержащиеся в них химические соединения имеют молекулярный уровень дисперсности. И мы уже разработали новый метод изготовления тест-объектов, чтобы измерять электронные спектры поглощения труднорастворимых координационных соединений. Во-вторых, МГФ-системы пригодны для фотографии. Вспомним, ведь их предшественники — галогенсеребряные светочувствительные материалы. Как обычно обрабатываются серебряные изображения? Отбеливанием, фиксированием и тонированием. Так вот, первые две стадии по составу используемых реагентов и химизму процессов соответствуют получению самой МГФ-системы, а третья — комплексообразованию в ней, но уже без серебра. Варьируя композиции отбеливающего и тонирующего растворов, а также время обработки ими, можно создать “металлокомплексные изображения” с очень разным составом и оптико-фотографическими характеристиками [5].
Потенциальные возможности металлохелатных желатиновых матриц этим, однако, отнюдь не исчерпываются. В принципе их можно применять в качестве иммобилизованных электродов, сенсоров, каталитических систем и многого другого.
Представленный материал дает основания говорить о создании нового научного направления в химии — изучения реакционной способности иммобилизованных в полимере координационных соединений и комплексообразования за счет межмолекулярных сил. По мнению автора, направления, достойного того, чтобы его развивать и по возможности — совершенствовать.
Исследования поддержаны Российским фондом фундаментальных исследований. Грант 96-03-32112.
ЛИТЕРАТУРА
1 Помогайло А.Д. Полимерные иммобилизованные катализаторы. М., 1988; Помогайло А.Д., Уфлянд И.Е. Макромолекулярные металлохелаты. М., 1991.
2 Михайлов О.В. // Успехи химии. 1995. Т.64. №7. C.704—720.
3 Mikhailov O.V. // Transition Metal Chemistry. 1996. V.21. №3. P.363—369.
4 Mikhailov O.V. // Reviews in Inorganic Chemistry. 1997. V.17. №4. P.287—332.
5 Михайлов О.В. // Успехи химии. 1997. Т.66. №8. C.735—749; Mikhailov O.V., Khamitova A.I., Kazymova M.A. // Нихон сясин гаккайси (Journal of Science of Photographic Science and Technology of Japan). 1998. V.61. №6. P.387—393.
Июль 2000 |