© В.П.Федин, О.А.ГераськоКукурбитурил: играем в молекулы
В.П.Федин, О.А.Герасько
Владимир Петрович Федин, доктор химических наук,
заместитель директора Института неорганической химии СО РАН.Ольга Анатольевна Герасько, кандидат химических наук,
старший научный сотрудник того же института.Все материальные предметы, которые нас окружают, состоят из молекул, соединенных между собой межмолекулярными связями разного типа и образующих более сложные структуры. Эти структуры возникают не случайно и не произвольно, а по вполне четким и ясным правилам: кирпичики, строительные блоки, создающие сложную конструкцию, обязательно соответствуют друг другу геометрически и функционально. Там, где в одном кирпичике углубление, в соседнем обязательно должна быть выпуклость, подходящая по размеру и форме, чтобы обеспечивать их эффективное соединение. И чем больше в каждом строительном блоке таких пригодных для сцепления мест, тем прочнее и устойчивее вся конструкция. Изучением процессов образования из отдельных молекул более сложных структур занимается специальная наука - супрамолекулярная химия, которая в настоящее время определяет основные направления развития в современной химии.
Супрамолекулярная химия
Термин “супрамолекулярная химия” введен в 1978 г. выдающимся французским химиком, лауреатом Нобелевской премии 1987 г. Ж.-М.Леном и определен им впоследствии как “химия за пределами молекулы, описывающая сложные образования, которые являются результатом ассоциации двух (или более) химических частиц, связанных вместе межмолекулярными силами” [1]. Последующее бурное развитие молодой науки в большой мере было обусловлено ее междисциплинарным характером. Супрамолекулярная химия охватывает разнообразные явления в органической и координационной химии, физической химии, биологии, физики, микроэлектроники и т.д. Благодаря их взаимному обогащению эта наука обладает широким спектром возможностей и привлекает все больше ученых из самых разных стран. В последние годы часто проводятся международные семинары, лекции, школы и конгрессы, посвящаемые данной области. Постоянно растет число публикаций, обзоров, монографий. Огромный интерес вызвала изданная в 1995 г. книга Лена “Супрамолекулярная химия. Концепции и перспективы”, переведенная в 1998 г. на русский язык. В ней подытожены основные направления исследований, предложен обобщающий взгляд на новую науку и обсуждены возможные перспективы ее развития [2].
Объекты классической химии - молекулы, объекты супрамолекулярной химии - супермолекулы и их ансамбли. Можно сказать, что “супермолекулы представляют собой по отношению к молекулам то же, что молекулы по отношению к атомам, причем роль ковалентных связей в супермолекулах играют межмолекулярные взаимодействия” [1, 3]. Существуют серьезные различия между молекулярной химией и химией больших (нанометровых размеров) соединений. Нельзя автоматически перенести, например, методы синтеза, разработанные для относительно малых молекул и позволяющие с высокой степенью надежности получать заранее заданные соединения, на наноразмерные молекулы.
Супрамолекулярные ансамбли представляют собой сложные конструкции определенной архитектоники. Они строятся самопроизвольно из комплементарных, т.е. обладающих геометрическим и химическим соответствием, фрагментов, подобно спонтанной сборке сложнейших пространственных структур в живой клетке. Подбор условий для такой сборки за счет перегруппировок молекул в бесконечно разнообразные комбинации и структуры приводит к материалам с новыми интересными свойствами.
Цель наших исследований - создание материалов с использованием молекулярных строительных блоков больших размеров. Такие блоки необходимы потому, что в супрамолекулярных ансамблях отдельные молекулы удерживаются межмолекулярными взаимодействиями, но каждое из них в целом значительно слабее, чем ковалентные связи в самой молекуле. Если использовать крупные, не меняющие свою геометрию фрагменты, то за счет большей контактной поверхности можно обеспечить множественные взаимодействия нескольких центров и увеличить тем самым суммарное связывание отдельных блоков.
В качестве подобных молекулярных блоков используются органические макроциклические соединения и относительно большие координационные кластеры металлов, где два атома металла (или более) связаны между собой. Эти соединения легкодоступны, растворимы и устойчивы в водных растворах минеральных кислот, а соответствие их геометрических размеров и координационных возможностей позволяет достичь высокой эффективности связывания при образовании супрамолекулярных ансамблей. Остановимся подробнее на описании молекулярных строительных блоков и создании из них супермолекул.
Молекулярные строительные блоки: кукурбитурил и кластеры
Кукурбитурил - тривиальное название органического макроциклического соединения состава C36H36N24O12, данное ему в 1981 г. В. Фриманом в связи с внешним сходством формы молекулы с тыквой (род Cucurbita) [4]. Действительно, строение этой интересной молекулы напоминает тыкву или бочку: в областях ее дна и крышки располагаются по шесть атомов кислорода сильно поляризованных карбонильных групп. Соединение было впервые получено еще в 1905 г. немецким химиком Р. Берендом [5]. Однако методы того времени не позволили правильно определить состав и структуру кукурбитурила, и лишь сравнительно недавно это удалось сделать с помощью рентгеноструктурного анализа [4]. Высота “бочки” оказалась равной 6 A, максимальный внутренний диаметр - 5.5 A, атомы же кислорода карбонильных групп образуют два одинаковых портала (т.е. вход и выход) с ван-дер-ваальсовым диаметром 4.2 A. Размеры ее внутренней полости позволяют включать “гостей” - небольшие органические молекулы или ионы.
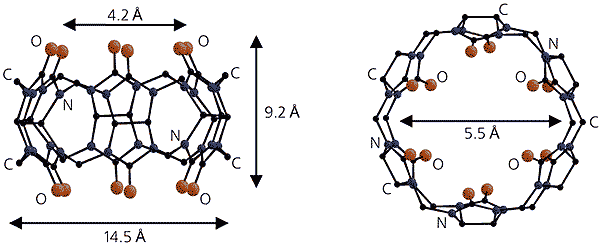
“Бочка” кукурбитурила - вид сбоку (слева) и сверху.
Кукурбитурил растворим в кислотах и щелочах, легкодоступен, устойчив и способен к координации различных частиц, что делает его удобным для синтеза разнообразных супрамолекулярных соединений [6-11]. Так, даже при очень низкой концентрации он чрезвычайно легко связывает кальций - один из наиболее важных и многофункциональных элементов в живых организмах [12]. Атомы кислорода обоих порталов одной молекулы координируют катионы кальция, а те в свою очередь “схватывают” с каждой стороны еще по “бочке”. В результате макроциклические молекулы кукурбитурила выстраиваются друг над другом и, чередуясь с катионами кальция, образуют бесконечные полимерные цепи - молекулярные “трубы”. Интересно отметить, что метильная группа координированной к кальцию молекулы метанола располагается внутри полости кукурбитурила, что свидетельствует о ее гидрофобности. Такие высокоупорядоченные органические-неорганические гибридные материалы с большими каналами, размеры и форму которых можно контролировать, представляют несомненный интерес для тонкой очистки, разделения и выделения веществ, супрамолекулярного катализа, а также оптоэлектроники.
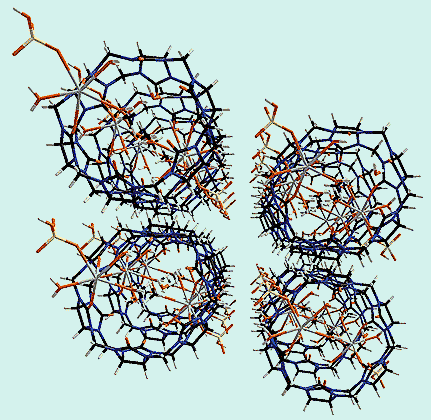
Молекулярные “трубы”, образованные супермолекулами кукурбитурила с катионами кальция.
Итак, имея один строительный блок - кукурбитурил, образно говоря, “бочку без дна и крышки”, - попробуем создать недостающие детали, способные закрывать ее с одной или двух сторон. “Крышки” должны хорошо подходить по размеру и образовывать межмолекулярные контакты с самой “бочкой”, и чем таких взаимодействий больше, тем лучше “крышки” будут удерживаться. Удачными в таком качестве оказались трехъядерные кластеры молибдена или вольфрама состава [M3Q4(H2O)9]4+ (M = Mo, W; Q = S, Se). Строение этих комплексов хорошо известно: атомы металла образуют треугольник, а из четырех имеющихся мостиковых атомов халькогена - серы или селена - один соединен с тремя атомами металла по одну сторону треугольника М3, а три располагаются по другую. Атомы металла дополнительно координированы молекулами воды, шесть из которых лежат примерно в одной плоскости и способны образовывать водородные связи с шестью атомами кислорода в портале. Кислотные свойства трехъядерных аквакомплексов облегчают образование водородных связей.
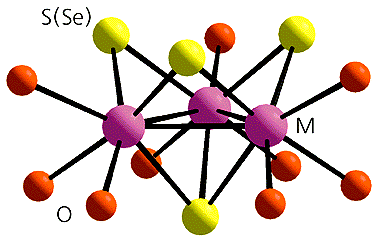
Трехъядерные координационные кластеры [M3Q4(H2O)9]4+ (M = Mo, W; Q = S, Se).Для создания прочных супрамолекулярных соединений необходимо как совпадение размеров “крышки” и “бочки”, так и образование между ними развитой системы водородных связей. Экспериментальные исследования подтвердили, что кластеры [M3Q4(H2O)9]4+ и кукурбитурил прекрасно отвечают обоим этим условиям. В результате удалось получить “бочки” двух типов: с одной “крышкой” и с двумя. Размеры таких супермолекул составляют 15 и 25 A соответственно. “Крышка” плотно закрывает “бочку” кукурбитурила с одной или с обеих сторон, а шесть молекул воды кластера соединяются с атомами кислорода портала максимально возможным числом водородных связей - 12 (!), благодаря чему строительные блоки прочно удерживаются вместе. Супрамолекулярные комплексы, полученные в виде красивых кристаллов из смеси разбавленных растворов исходных соединений - кукурбитурила и кластеров, - уже более не растворяются ни в воде, ни в кислотах [12-19].
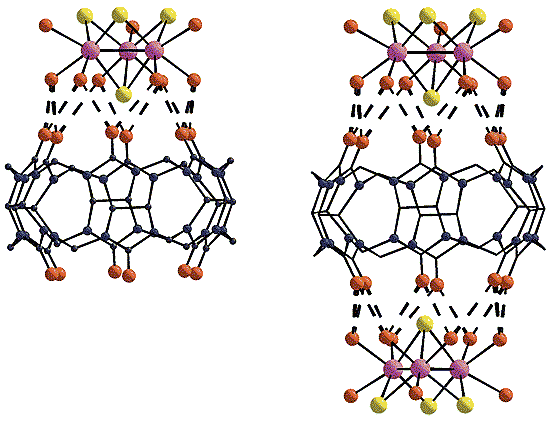
Супермолекулы-“бочки”: с одной “крышкой” (слева) и с двумя.
Водородные связи показаны пунктирными линиями.Что можно построить из супермолекул?
Сделаем следующий шаг: попробуем использовать в качестве строительных блоков уже сами супермолекулы и посмотрим, как они организуются дальше, как взаимодействуют друг с другом, как образуют твердое тело.
Обычно в кристалле супермолекулы-“бочки”, независимо от того, с одной они “крышкой” или с двумя, выстраиваются в бесконечные полимерные цепочки. Здесь свою роль играют не только водородные связи, но и межмолекулярные ван-дер-ваальсовы взаимодействия между атомами серы (или селена) соседних трехъядерных координационных кластеров [16].
Образование коротких контактов сера-сера или селен-селен в супрамолекулярных соединениях чрезвычайно интересно тем, что они могут служить молекулярной моделью для слоистых дихалькогенидов переходных металлов, значение которых в промышленности трудно переоценить. Например, дисульфид молибдена - это прекрасный смазочный материал, сохраняющий свои свойства при очень низких температурах и в глубоком вакууме (даже в космосе!). В структуре подобных дихалькогенидов слои из атомов металла чередуются с двумя слоями из атомов халькогена (серы или селена), причем последние взаимодействуют друг с другом в соседних слоях тем же самым образом, что и в полученных нами супрамолекулярных соединениях.
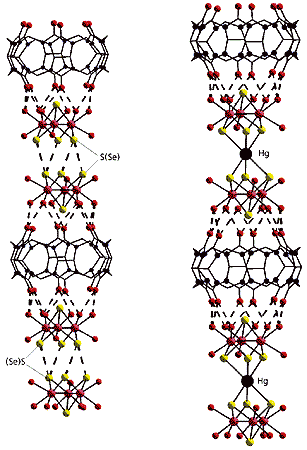
Полимерные цепочки из супермолекул,
соединенных между собой атомами халькогена (S или Se)
или за счет координации ртути к атомам халькогена.
Пунктирными линиями показаны водородные связи
и контакты между атомами халькогенов.Характернейшая особенность слоистых дихалькогенидов металлов - способность включать между слоями халькогена “гостей”: атомы металлов или малые молекулы. Такое внедрение приводит к раздвиганию слоев и позволяет целенаправленно менять свойства материалов. Атомы серы (или селена) трехъядерных кластеров могут, например, координировать атомы ртути [16-18]. Важно, что при этом размеры и геометрия треугольного кластерного фрагмента практически не меняются, а значит, он также способен взаимодействовать с кукурбитурилом и образовывать супрамолекулярные соединения. В них атом ртути координируется через атомы селена к “крышкам” соседних супермолекул кукурбитурила, связывая их в бесконечные цепочки. За счет включения ртути расстояние между атомами селена увеличивается так же, как в слоистых дихалькогенидах металлов при интеркалировании “гостей” между слоями. Эти результаты наглядно показывают, что химия твердого тела гораздо теснее связана с химией молекулярных кластеров, чем можно было ожидать. Даже вторичные эффекты, например нековалентные взаимодействия между атомами халькогена, служат важным фактором в образовании структуры как для создания неорганических материалов (дихалькогенидов переходных металлов), так и для упаковки изучаемых нами супермолекул.
“Гости” в “бочке”
А теперь рассмотрим упомянутую ранее способность кукурбитурила включать в свою полость небольшие молекулы. Известно, что подобные явления играют исключительно важную роль в самых разнообразных процессах: дыхании и регенерации кислорода растениями, ферментативном катализе, анестезии, формировании залежей природного газа и т.д. Наличие у кукурбитурила одной или двух “крышек” создает более благоприятные условия для внедрения и удержания “гостя” в полости супермолекулы. Так, если добавить в реакционную смесь пиридин, он окажется внутри “бочки” с двумя “крышками” [14, 19], несмотря на то, что ван-дер-ваальсов радиус этой органической молекулы (5.9 A) несколько больше внутреннего диаметра входного отверстия кукурбитурила (4.2 A). Образование такого супрамолекулярного соединения настолько выгодно, что в условиях реакции атомы кислорода порталов, по-видимому, отклоняются от своих позиций и впускают “гостя” в полость. Отметим, в новом соединении немного искажены молекулы и “гостя”, и самого кукурбитурила, но во всем остальном строение этого супрамолекулярного комплекса сходно с теми цепочками, которые получаются без пиридина. В полость кукурбитурила можно включать также другие небольшие молекулы, такие как тетрагидрофуран, бензол, диоксан.
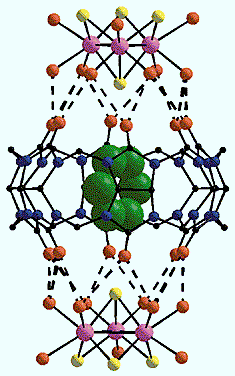
Ансамбль “хозяин-гость”.
"Хозяин” - это супермолекула, закрытая с двух сторон “крышками”,
а “гость” - включенная в полость молекула пиридина (зеленые шары).Итак, закрывая “бочку” “крышками”, мы вполне надежно размещаем в ней “гостей”. Ясно, что они способны покинуть “бочку” только при открытых “крышках”. Можно ли подобрать экспериментальные условия, которые позволили бы контролировать образование и разрыв связей между исходными строительными блоками и, следовательно, открывать и закрывать “крышки”, впускать и выпускать “гостя” из полости? Да, и, как оказалось, очень легко. Увеличивая, например, концентрацию соляной кислоты, мы заменяем атомами хлора молекулы воды, координированные к металлу треугольного кластера и ответственные за образование водородных связей. Их система рушится, “крышки” снимаются, и “гость” покидает полость. Если условия реакции снова изменить, так чтобы молекулы воды заняли места атомов хлора, опять получатся супрамолекулярные соединения, в которых “крышки” эффективно закрывают “бочку” кукурбитурила.
Изучение обратимого включения “гостей” в полость молекулы “хозяина” представляет интерес не только с научной точки зрения. Оно вносит существенный вклад и в развитие исследований по возникшей в последнее время проблеме транспорта веществ, в том числе лекарств, и позволяет осуществлять направленное конструирование молекулярных “контейнеров”. За счет взаимодействия “гость-хозяин”, например, можно было бы включать в полости органических макроциклических соединений сильнодействующие лекарственные препараты, избирательно доставлять их в необходимое место в организме человека и в нужный момент открывать “крышки”.
Простота в получении, стабильность в растворах минеральных кислот, термическая устойчивость (кукурбитурил не разлагается при нагревании до 400°С!), высокая тенденция к координации различных частиц делают кукурбитурил более приемлемым для создания супрамолекулярных соединений, чем другие широко используемые макроциклы, такие как циклодекстрины, каликсарены. К настоящему времени разработаны методы синтеза кукурбитурилов более крупных размеров, “бочек” большего диаметра, с семью, восемью и более атомами кислорода в каждом портале. Такие молекулы способны образовывать больше водородных связей, за счет чего супрамолекулярные соединения становятся прочнее. Большие молекулярные “контейнеры” смогут вмещать в себя и более крупных “гостей”. Например, трехъядерные кластеры, которые мы использовали в качестве “крышек”, здесь будут выступать уже в качестве включенных в полость макроциклического лиганда “гостей”. Это открывает уникальные возможности для создания новых гибридных органических-неорганических материалов.
Работа выполнена при поддержке Российского фонда фундаментальных исследований.
Проекты 99-03-32788, 01-03-32789.Литература
1. Lehn J.-M. // Angew. Chem. 1988. V.100. P.91-93.
2. Лен Ж.-М. Супрамолекулярная химия. Концепции и перспективы. Новосибирск, 1998.
3. Lehn J.-M. // Science. 1985. V.227. P.849-856.
4. Freeman W.A., Mock W.L., Shih N.-Y. // J. Am. Chem. Soc. 1981. V.103. P.7367-7370.
5. Behrend R., Meyer E., Rusche F. // Liebigs Ann. Chem. 1905. V.339. P.1.
6. Mock W.L. // Comprehensive Supramolecular Chemistry. / Ed. F.Vцgtle. V.2 Oxford, 1996. P.477-493.
7. Cintas P. // J. Incl. Phenom. Molec. Rec. Chem. 1994. V.17. P.205-220.
8. Jeon Y.-M., Kim J., Whang D., Kim K. // J. Am. Chem. Soc. 1996. V.118. P.9790-9791.
9. Whang D., Heo J., Park J.H., Kim K. // Angew. Chem. Int. Ed. 1998. V.37. P.78-80.
10. Heo J., Kim J., Whang D., Kim K. // Inorg. Chem. Acta. 2000. V.297. P.307-312.
11. Heo J., Kim S.-Y., Whang D., Kim K. // Angew. Chem. Int. Ed. 1999. V.38. P.641-643.
12. Самсоненко Д.Г., Шаронова А.А., Соколов М.Н. и др. // Координац. химия. 2001. Т.27. С.12.
13. Samsonenko D.G., Sokolov M.N. Virovets A.K. // Eur. J. Inorg. Chem. 2001. P.167-172.
14. Fedin V.P., Virovets A.V., Sokolov M.N. et al. // Inorg. Chem. 2000. V.39. P.2227-2230.
15. Самсоненко Д.Г., Вировец А.В., Шаронова А.А., и др. // Изв. РАН. Сер. хим. 2001. Т.3. С.475-477.
16. Sokolov M.N., Virovets A.V., Dybtsev D.N. et al. // Angew. Chem. 2000. V.112. P.1725-1727.
17. Соколов М.Н., Дыбцев Д.Н., Вировец А.В. и др. // Изв. РАН. Сер. хим. 2000. Т.11. С.1905-1909.
18. Дыбцев Д.Н., Герасько О.А., Вировец А.В. и др. // Журн. неорган. химии. 2001. Т.46. №6. С.908-914.
19. Dybtsev D.N., Gerasko O.A., Virovets A.V. et al. // Inorg. Chem. Comm. 2000. V.3. P.345-349.