№8, 2005 г.
© Недоспасов А.А., Беда Н.В.
“Перфторан”: революционная комбинация
А.А.Недоспасов, Н.В.Беда
Андрей Артурович Недоспасов, д.х.н.
Наталия Владимировна Беда, м.н.с.
Институт молекулярной генетики РАН“Нет ничего более практичного, чем хорошая теория” - фундаментальная наука неизбежно находит выход в практику. Увы, в родном отечестве эта аксиома все чаще оказывается теоремой, проблемой, а то и просто иллюзией. Быть может, фундаментальные исследования, описанные в этой работе, позволят восстановить статус-кво и минимизировать ущерб от возникшего дисбаланса.
Многие лекарственные препараты и методы лечения, открытые задолго до “эры NO”, в большей или меньшей степени влияют на метаболизм оксидов азота, но действие это часто остается незамеченным, а лечебные эффекты объясняются какими-то другими причинами. Яркий пример тому - клиническое применение искусственных кровезаменителей на основе перфторорганических соединений (ПФС), известных в России под названиями “Голубая кровь” и “Перфторан” [1-3].
Идея ПФС-кровезаменителей возникла в конце 60-х годов XX в. Поскольку жидкие ПФС прекрасно растворяют кислород, эмульсии из них могли бы выполнять газотранспортную функцию эритроцитов крови. Исследования активно велись в Японии, СССР и США. В 80-е годы, во время афганской войны, опытные партии советских препаратов спасли немало жизней раненым, обреченным на неминуемую смерть от потери крови. В настоящее время “Перфторан” допущен к клиническому применению и свободно продается в аптеках.
Со временем выяснилось, что применение “Перфторана”, в том числе в малых дозах, часто дает положительные эффекты, для которых связь с его газотранспортной функцией не просматривается. Одновременно обнаружили ряд побочных эффектов, также не находивших объяснения. Сегодня многие из них стали понятны благодаря представлениям о мицеллярном окислительном нитрозировании *. Этот термин, предложенный нами для введения радикала ·NO в гетерогенной среде, подразумевает, что в значительной степени реакции идут по радикальному механизму: молекула NO реагирует со свободным радикалом, образовавшимся из молекулы-мишени под действием ·NO2 - продукта окисления NO.
* Подробнее см.: Недоспасов А.А., Беда Н.В. Биогенные оксиды азота // Природа. 2005. №7. С.33-39.Перфторуглеводороды (ПФУ) - экстремально гидрофобные вещества с большим коэффициентом распределения Q для кислорода и NO в смесях с водой. Кислород растворяется в них (в гидрофобной фазе эмульсии) гораздо лучше, чем в воде или плазме крови, из-за чего они и нашли применение в составе кровезаменителей. Благодаря мицеллярному катализу микрокапли эмульсии в крови действуют как губки для обоих газов, именно в них происходит теперь основная часть окисления NO.В предыдущей статье мы рассматривали влияние гидрофобных фаз на процессы окисления NO (например, при образовании холестериновых бляшек на стенке кровеносного сосуда). При сравнении с эмульсией ПФС-кровезаменителей заметны три существенных отличия.
Во-первых, гораздо выше значения Q. Поскольку ускорение реакции окисления NO при введении оптимальных количеств гидрофобной фазы пропорционально QNO в присутствии “Перфторана” окисляется гораздо быстрее [4, 5]. При этом увеличиваются скорости нитрозирования и других процессов, зависимых от мицеллярного катализа, - все они протекают преимущественно в искусственной гидрофобной фазе или на границе раздела фаз. Концентрация NO в водной фазе первоначально падает, что приводит к активации ферментов NO-синтаз, поставляющих NO.
Во-вторых, капли эмульсии не смачивают стенки сосудов (перфторуглеводороды вообще ничего не смачивают из имеющихся в организме поверхностей раздела фаз). Более того, NO из холестериновых бляшек и других “обычных” гидрофобных фаз также частично переходит в капли эмульсии. Значит, повреждающее действие продуктов окисления NO на стенки сосудов уменьшается.
В-третьих, линейные размеры капель эмульсии в “Перфторане” менее 0.1 мкм (диаметр эритроцита ~20 мкм, а холестериновой бляшки много больше); соответственно, отношение поверхности к объему оптимально для протекания реакций нитрозирования на границе раздела. Если в окружающем пространстве присутствуют тиолы (RSH), капля эмульсии может действовать как миниатюрный реактор по производству тионитритов (RSNO). В норме в плазме крови довольно высокая концентрация восстановленного глутатиона (трипептида, содержащего остаток цистеина со свободной HS-группой), нитрозоформа которого - прекрасный донор NO.
Таким образом, аналогия капли перфторуглеводородной эмульсии с эритроцитом оказалась гораздо глубже, чем полагали сначала: оба переносят и кислород, и углекислый газ, и NO/RSNO. Понятно, что даже малые дозы кровезаменителей типа “Перфторана”, введенные в кровяное русло, обладают эффектом, характерным для нитроглицерина (основы динамита и одновременно популярного лекарства), т.е. вызывают релаксацию сосудов и восстанавливают кровообращение.
В первых опытах на крысах было наглядно продемонстрировано влияние эмульсий перфторуглеводородов на метаболизм NO: при введении “Перфторана” наблюдались предсказанные колебания концентраций нитрита и нитрата в плазме, изменения частоты сердечных сокращений, обычные при действии вазодилаторов типа нитроглицерина. Ингибирование NO-синтаз снимало эти эффекты [6]. Несколько лет спустя эту работу повторили в США [7].
Побочные эффекты применения кровезаменителей типа “Перфторан” во многих случаях проявлялись не сразу, а спустя значительное время после переливания крови. Поверхностно-активные вещества, используемые для стабилизации эмульсий при создании ПФУ-кровезаменителей, выводятся из организма гораздо быстрее, чем сами ПФУ (характерные времена - сутки и месяц соответственно). Если в первые часы после введения эмульсия становится основным местом окисления NO, то через сутки процессы перемещаются главным образом в естественные липидные фазы организма, в которых растворились ПФУ. Ясно, что в организме они (в виде отдельной фазы или растворенные в имеющихся гидрофобных фазах) будут влиять не только на параметры мицеллярного окисления NO из-за роста QO2 и, особенно, QNO, но и на все последующие процессы, включая нитрование и нитрозирование липидов, белков и нуклеиновых кислот. Таким образом, “отравления” под действием химически инертных перфторуглеводородов, в том числе газообразных, растворяющихся в липидах, можно объяснить потерей устойчивости системы регуляции метаболизма оксидов азота.
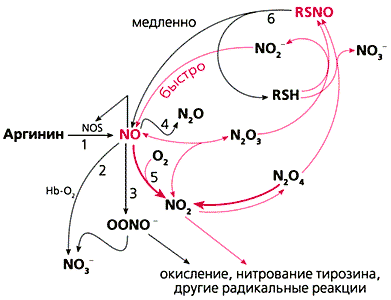
Рис.1. Схема биосинтеза NO и основные метаболические пути оксидов азота.
Ускорение окисления NO кислородом отражается на равновесии высших оксидов азота; при этом их стационарные концентрации меняются. Если электрофильное нитрозилирование (образование RSNO, рис.1) преимущественно протекает под действием NO+ (N2O3, N2O4), а радикальные реакции (включая нитрование и окисление белков и нуклеиновых кислот) - под действием ·NO2, то при использовании искусственных гидрофобных фаз в качестве кровезаменителей желательно сместить равновесие в сторону первых, во всяком случае не увеличивать стационарные концентрации NO2.
Концентрации высших оксидов азота при окислении NO чрезвычайно низки, и измерить их обычными методами не удается. Мы нашли простой и чувствительный способ, основанный на определении нитрата в продуктах окисления. Нитрат восстанавливается в нитрит соединениями ванадия, скорость этого процесса измеряют с помощью реакции Грисса (по образованию красителя). Если из образца удалить имевшийся первоначально (до восстановления нитрата) нитрит, весь образовавшийся краситель будет происходить из нитрата. Поскольку в результате гидролиза N2O3 получается только нитрит
N2O3 + H2O = 2HNO2, (1)
а при гидролизе N2O4 - эквимолярная смесь нитрита и нитрата
N2O4 + H2O = HNO2 + HNO3, (2)
доля нитрата в продуктах будет мерой стационарных концентраций обоих оксидов. В целом, в малополярных гидрофобных фазах стабилизация N2O3 при сольватации минимальна, распад на NO и NO2 усиливается, и доля NO2 должна расти:
NO2 + NO = N2O3. (3)
Анализ системы уравнений для стационарных концентраций оксидов азота показал, что возможно снижение [NO2]ст независимо от изменений [NO]ст и общего пула оксидов азота [8]. В частности, избирательно ускоряя нитрозилирование, мы снижаем не только [N2O3]ст, но и [NO2]ст, т.е. скорости всех радикальных реакций с его участием. В этой связи поиск катализаторов нитрозилирования/денитрозилирования становится важной задачей биохимии.
Рис.2. Гистограмма, отражающая вклад гетерогенности среды и катализаторов денитрозирования в баланс нитрит/нитрат при окислении NO. Слева: в гетерогенной среде скорость окисления NO выше, чем в гомогенной. Обычно система равновесий высших оксидов азота сдвигается в сторону NO2 и N2O4, и доля нитрата в продуктах возрастает. Triton X 100 - детергент (аналог мыла), использованный для получения липосом (по данным Liu et al., 1998). Справа: хотя в CF-эмульсиях скорость окисления NO возрастает сильнее, чем в обычных липидах, сольватация и скорости гидролиза высших оксидов азота изменены. В присутствии “Перфторана” доля нитрата в продуктах ниже, чем в гомогенном водном растворе (левая пара столбиков). Фосфат (PO4– 3 ), пиро- (P2O7–4 ) и триполифосфат (P3O10–5 ) ускоряют гидролиз N2O3 в нитрит. В результате стационарные концентрации NO2 и N2O4 уменьшаются и выход нитрата падает. Видно, что полифосфат гораздо активнее, чем фосфат. Hepes - компонент буферного раствора.Сравним влияние гетерогенности среды и сольватации на нитрит-нитратный баланс в продуктах окисления NO в присутствии обычных липидов и в “Перфторане” (рис.2). Видно, что в первом случае при добавлении гидрофобной фазы доля нитрата (а значит, вызываемых ·NO2 радикальных реакций!) растет, во втором оказывается ниже, чем в гомогенном водном растворе [9]. Отчасти эффект связан с каталитическим действием полиэфирного стабилизатора эмульсии на реакцию нитрозирования. Его можно усилить с помощью других найденных нами катализаторов. На рис.2 в качестве иллюстрации показаны каталитические эффекты фосфата и триполифосфата. При увеличении скорости гидролиза N2O3 (фактически - нитрозилирования воды) уменьшаются стационарные концентрации как N2O3, так и NO2 из-за сдвига равновесия в реакции (3).Впрочем, и здесь не обошлось без парадоксов и неожиданностей. Перфторуглеводороды и их гетероаналоги (вещества, содержащие помимо C и F другие атомы; например, перфтороктилбромид - ПФБ), близкие по растворяющей способности в отношении кислорода, считались одинаково инертными. Поэтому при создании кровезаменителей выбор конкретных соединений был случайным и определялся в значительной степени давлением пара и доступностью в чистом виде. (В промышленности ПФУ и их гетероаналоги получают для далеких от медицины целей, в частности для электротехники.) Так, основу “Перфторана” составляет смесь изомеров перфтордекалина и перфтор-(4-циклогексил,N-метил)пиперидина (рис.3). В Японии и США наиболее популярен перфтороктилбромид (C8F17Br, ПФБ; в кровезаменителях “Перфлюброн”, “Оксиджент” и др.).
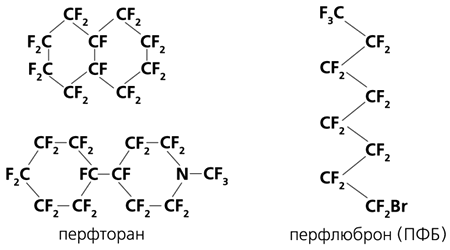
Рис.3. Формулы перфторорганических соединений, используемых в производстве кровезаменителей.
Интересно, что сегодня перфтороктилбромид применяется при искусственной вентиляции легких. В легкие пациента (чаще в одно) вводят жидкий ПФБ (~1 л) и шланг с распылителем для подачи воздуха или кислорода. По завершении процедуры шланг удаляется, а ПФБ остается в легких и медленно (недели-месяцы) выводится с выдыхаемым воздухом, а часть его обнаруживается в крови.
Неоднократно отмечалось, что физиологические свойства и кровезаменителей на основе перфторуглеводородов, перфтороктилбромидов и чистых компонентов различны. Причины этого оставались непонятными. Действительно, если бы эффекты этих соединений сводились лишь к транспорту кислорода, они были бы одинаковы для всех ПФУ и ПФБ, поскольку значения коэффициента распределения NO для перфтороктилбромидов и не содержащих атома брома перфторсоединений, включая перфтордекалин (основной компонент “Перфторана”), также оказались близкими. Таким образом, объяснить различные физиологические эффекты только разной сольватацией NO не удалось. В этой связи мы поставили под сомнение постулат об инертности перфтороктилбромидов in vivo и начали искать природные супернуклеофилы, способные реагировать с ним при температуре тела [10].
Для перфторалкилгалогенидов были известны реакции перфторалкилирования при катализе низковалентными комплексами никеля и кобальта. Наиболее известная форма существования кобальта in vivo - кобаламин (витамин В12), который в восстановленной форме служит кофактором ряда ферментов (рис.4). Мы показали, что кобаламин активирует ПФБ, видимо, с образованием перфтороктильного радикала и Co(II), который может снова восстанавливаться до Co(I). Значит, витамин В12 в присутствии восстановителей играет роль катализатора перфторалкилирования под действием ПФБ. Реакцию удалось “визуализировать” с использованием флюоресцирующих мишеней. В тех же условиях связь C-F оказалась устойчивой: мы не обнаружили перфторалкилирования под действием перфтордекалина. Судьба гидрофобных перфторалкильных радикалов in vivo остается неизвестной. Вероятно, они способны эффективно реагировать с NO (природным инактиватором свободных радикалов), образуя новые токсичные продукты.
Рис.4. Схема катализа кобаламином (витамином В12) реакций перфторалкилирования под действием перфторалкилгалогенидов. In vivo кобаламин восстанавливается до Со+1. Этот супернуклеофил способен “вырвать” атом брома из молекулы перфторалкилбромида (показана как CFBr). Образующийся перфторалкильный радикал CF· вступает в реакции с активированными двойными связями (показан замещенный акриламид, Х - флюоресцирующая группа), ароматическими соединениями и др. Вновь образовавшиеся радикалы (2) стабилизируются различными путями, приводя к стабильным CF-содержащим продуктам (3, 4).Принципиальное отличие ПФУ и ПФБ в отношении к супернуклеофилам типа восстановленных форм кобаламина позволяет объяснить различие свойств кровезаменителей на их основе: ПФБ в физиологических условиях нельзя считать химически инертным. Аналогичные объяснения применимы и к многочисленным отравлениям другими перфторалкилгалогенидами (ПФГ): помимо механизмов, связанных с NO-катастрофами, они могут участвовать в реакциях перфторалкилирования обычных метаболитов. Ясно, что низкие концентрации кобаламина в тканях делают их малозаметными, но не менее неприятными, особенно при больших “периодах полувыведения” (мера времени жизни в организме) высших гомологов. Не исключено, что в качестве восстановителей ПФГ, помимо B12, могут выступать и другие метаболиты. Поскольку современный уровень знаний не позволяет оценить отдаленные последствия и степень риска, эксперименты с использованием перфторалкилгалогенидов на людях следовало бы предельно ограничить.Общее число пациентов, получивших большие дозы перфтороктилбромидов по медицинским показаниям, и добровольцев, участников испытаний, неизвестно, но заведомо пятизначное. Низшие газообразные перфторалкилгалогениды используются как растворители, в том числе при химической чистке одежды, как фреоны (бромтрифторметан), а также в огнетушителях и автоматических противопожарных системах - от военной техники до космических кораблей многоразового использования (“Спейс Шаттл”). Описано множество случаев отравлений, в том числе со смертельным исходом, при вдыхании газообразных перфторалкилгалогенидов. Очевидно, что и длительность воздействия, и концентрации этих веществ (в частности, в наших химчистках самообслуживания) могут меняться в широких пределах. Известны примеры, когда серьезные проблемы со здоровьем и смерть наступали спустя значительное время после отравления ПФГ.
Открытие перфторалкилирования при катализе известным витамином после 40 лет работ по использованию ПФГ в медицине поднимает серьезные философские вопросы. Корреляция между появлением озоновых дыр и попаданием фреонов в атмосферу - факт, установленный в ходе фундаментальных научных исследований. Реакция образования перфторалкильных радикалов при облучении фреонов ультрафиолетом попала не только в вузовские, но и в школьные учебники. Связь алкилирования ДНК и свободно-радикальных реакций с мутациями и раком должен уметь объяснить любой выпускник средней школы. Аналогия между озоном и высокоактивными метаболитами, участвующими в реакциях окисления (в том числе при биосинтезе NO), также кажется достаточно очевидной. Тем не менее тысячам добровольцев и пациентов вводили и продолжают вводить большие дозы ПФГ, которые остаются в организме на месяцы. Остается загадкой, почему и у участников, и у организаторов таких экспериментов, несмотря на все эти знания, никогда не возникал вопрос о химической инертности ПФГ in vivo. Отрицательный ответ на этот вопрос мог и должен был быть получен много лет назад, до начала массовых экспериментов на людях.
Сегодня острая необходимость в изучении биохимии ПФГ и методов детоксикации этих соединений и их потенциальных метаболитов очевидны, поскольку, несмотря на предупреждения экологов, их по-прежнему широко используют в технике и в быту, и случайные контакты с ними в случае разного рода аварий и форс-мажорных обстоятельств будут случаться и впредь даже при полном прекращении использования перфтороктилбромидов в медицине. Не исключено, что эффективным методом выведения труднолетучих ПФГ и продуктов их превращений окажется кратковременное введение стабилизированных эмульсий химически инертных перфторуглеводородов (типа “Перфторана”) с последующим удалением их гемосорбцией вместе с “экстрагированными” перфторалкилгалогенидами.
В заключение мы хотим привести примеры популярных препаратов, механизм действия которых связан с регуляцией метаболизма оксидов азота. Напомним, что NO синтезируется из аргинина под действием NO-синтаз (NOS) и активирует гуанилатциклазу (GC), поставляющую цикло-ГМФ, который и служит молекулярным сигналом к расширению сосудов (рис.5). Нитроглицерин и амилнитрит как искусственные доноры NO при сердечной недостаточности обеспечивают расширение сосудов миокарда и предотвращают развитие инфаркта. Более того, они могут быть полезны даже на ранних стадиях после случившегося инфаркта или инсульта: помимо возобновления кровотока (благодаря активации гуанилатциклазы), образующийся NO действует как детоксикатор свободных радикалов, концентрация которых резко возрастает после инфаркта или инсульта, что и служит причиной гибели клеток сердечной мышцы или мозга. В последние годы в качестве эффективной экстренной меры пациента помещают в атмосферу с очень небольшим количеством NO. * * *
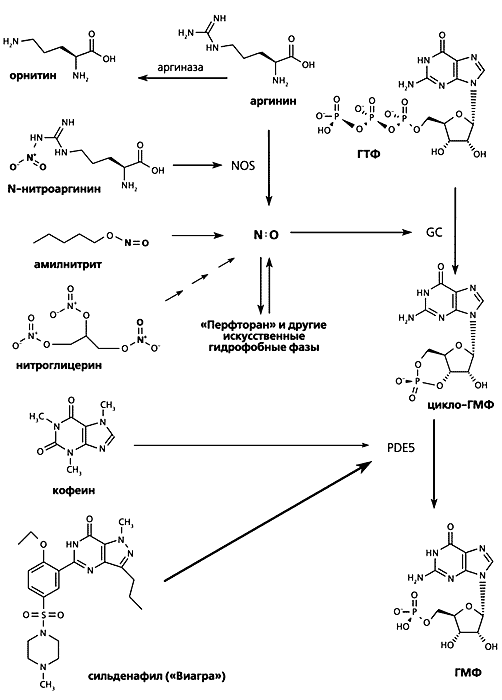
Рис.5. Популярные фармацевтические препараты, механизм действия которых связан с регуляцией метаболизма оксидов азота.Развитие септического шока связано с чрезмерной активностью NO-синтазы, индуцированной попавшими в кровоток патогенами. Организм, пытаясь обезопасить себя от вторжения чужеродных клеток, производит большие количества NO для их уничтожения. Это приводит к активации гуанилатциклазы, слишком сильному расширению сосудов, как следствие - к падению давления крови. Смерть наступает от снижения эффективности кровообращения. Ингибиторы NO-синтазы (например, нитроаргинин) или введение в кровь аргиназы (фермента, разрушающего аргинин - предшественник NO) могут быть спасительными.
Уровень цикло-ГМФ поддерживается балансом активностей гуанилатциклазы (синтез) и специфической фосфодиэстеразы PDE5 (распад). Ингибирование последней обеспечивает высокую концентрацию цикло-ГМФ даже при недостатке синтеза NO, активирующего гуанилатциклазу. Кофеин - слабый и неспецифический ингибитор фосфодиэстераз, расщепляющих цикло-ГМФ. Сильденафил (“Виагра”) - мощный и специфический ингибитор фосфодиэстеразы PDE5 - оказался эффективным средством при импотенции (злые языки утверждают, что именно это открытие было решающим для членов Нобелевского комитета). Тот же эффект может быть достигнут ингибированием аргиназы.
“Перфторан” и другие искусственные гидрофобные фазы могут выступать и как активаторы, и как блокаторы различных NO-зависимых процессов. Растворимость NO и O2 в эмульсии перфторуглеводорода выше, чем в плазме крови, что первоначально обеспечивает переток NO из плазмы в гидрофобную фазу эмульсии, где из-за мицеллярного катализа скорость его окисления выше, чем в окружающей капли эмульсии плазме. В целом, концентрация NO в крови падает (показано красной стрелкой), одновременно падает необратимое окисление NO в нитрат под действием гемоглобина. Снижение концентрации растворенного NO может активировать NOS. Продукты окисления NO преимущественно образуются в эмульсии, и именно там выше нитрозилирующая активность. Дальнейшая судьба продуктов окисления может регулироваться; возможен вариант, когда эмульсия становится источником NO-доноров.
Скорости накопления знаний, появления новых технологий к началу третьего тысячелетия стали буквально фантастическими. В существенной степени столь бурный рост имеет автокаталитический механизм: он обеспечивается успехами науки в предшествующие годы и регулируется скоростью превращения фундаментальных научных открытий в новые технологии, используемые как для “потребления”, так и для дальнейшего развития исследований. Для биологических наук примерами первых являются появление методов диагностики и лечения неизлечимых ранее заболеваний или выведение высокопродуктивных сельскохозяйственных культур. Ко вторым можно отнести все более тонкие методы анализа (веществ, клеток и целых организмов) или синтеза сложных “биологических” молекул. В целом, предшествующие успехи в фундаментальных исследованиях предопределяют новые достижения как в экономике, так и в самой науке.
Работа выполнена при поддержке Российского фонда фундаментальных исследований.
Проекты 02-04-49530 и 03-04-06492.
Литература
1. Шноль С.Э. Герои и злодеи российской науки. М., 1997.
2. Иваницкий Г.Р. // Биофизика. 2001. V.46. P.5-33.
3. Squires J.E. // Science. 2002. V.295. P.1002-1005.
4. Gordin V.A., Nedospasov A.A. // FEBS Lett. 1998. V.424. P.239-242.
5. Рафикова О.В. // Татьянин день. Мицеллярный катализ окисления оксида азота в эмульсиях перфторуглеводородов и его влияние на цикл оксида азота в организме млекопитающих. М., 2000.
6. Rafikova O., Sokolova E., Rafikov R., Nudler E. // Circulation. 2004. V.110. P.3573-3580.
7. Nedospasov A.A. // J. Biochem. Molecular. Toxicol. 2002. V.16. P.109-120.
8. Беда Н.В., Пименова (Сунцова) Т.П., Недоспасов А.А. // Проблемы и перспективы молекулярной генетики / Ред. Е.Д.Свердлов. М., 2004. Т.2. C.237-301.
9. Беда Н.В., Недоспасов А.А. // Биохимия. 2003. Т.68. С.1697-1704.