№12, 2003 г.
© О.В. МихайловКак склеить “химический кувшин” из осколков
О.В. Михайлов
Олег Васильевич Михайлов, д.х.н., проф. каф. аналитической химии, сертификации и менеджмента качества
Казанского государственного технологического университета.История, о которой пойдет рассказ, началась почти три четверти века назад, в 1927 г. Пытаясь синтезировать 1,2-дицианобензол из цианида меди(I) и 1,2-дибромбензола в пиридине при 200°С, химики наряду с целевым продуктом обнаружили (правда, в небольшом количестве) необычное вещество с интенсивной темно-синей окраской. Установить его природу тогда не удалось, что хотя и не доставило ученым большой радости, но и особого огорчения тоже не вызвало, и о нем довольно быстро забыли.
Продолжение этой истории последовало более 30 лет спустя, когда в начале 1960 г. малоизвестный в ту пору новозеландский химик Н.Куртис произвел нехитрый эксперимент - попытался растворить в ацетоне перхлорат трис(1,2-этилендиамино)никеля(II). Куртис вынужден был отлучиться из лаборатории на некоторое время, а по возвращении неожиданно для себя обнаружил, что из раствора выпали красивые ярко-желтые кристаллы. Пытаясь разобраться в необычном феномене, он сначала решил, что это результат хорошо известной в органической химии реакции дегидратации (схема 1). Но потом понял, что ошибался. Хотя без дегидратации здесь и впрямь не обошлось, в действительности образовались координационные соединения никеля(II) с новыми тетрадентатными лигандами L1 и L2 (схема 2).
Схема 1. Реакция дегидратации, которую Н.Куртис счел сначала “виновницей” образования нового координационного соединения, выпавшего в осадок при стоянии в виде ярко-желтых кристаллов.Вскоре американский химик Д.Буш обратил внимание на весьма специфическое образование комплекса при взаимодействии 2-аминобензальдегида с ионами ряда 3d-элементов. К тому времени выраженная способность этого соединения к самоконденсации с возникновением линейных и циклических полимеров уже не была откровением. Изучавшие 2-аминобензальдегид незадолго до Буша его соотечественники Г.Эйхорн и Р.Латиф высказали мнение, что ионы 3d-элементов вступают в комплексообразование с его линейным тримером. Буш, однако, установил, что на самом деле ситуация куда сложнее и интереснее: в присутствии VO(II) возникают координационные соединения с циклическим тримером 2-аминобензальдегида (схема 3), другие металлы - железо, кобальт, медь, цинк, палладий или платина (все со степенью окисления 2) - с его циклическим тетрамером (схема 4), а при наличии Ni(II) и Co(III) образуется смесь комплексов обоих этих типов.
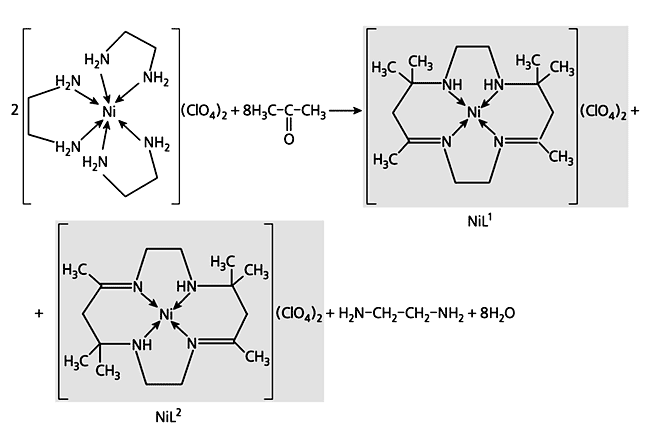
Схема 2. Последовательность стадий темплатного синтеза, в действительности осуществленного Куртисом.
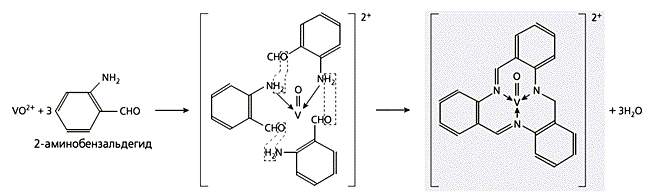
Схема 3. Образование комплексного соединения при взаимодействии ванадия с 2-аминобензальдегидом,
который в процессе синтеза конденсируется в циклический тример.
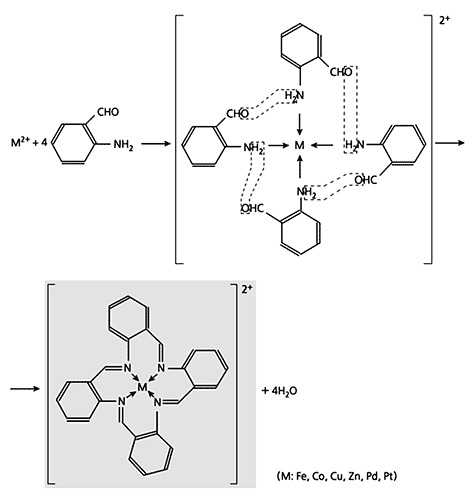
Схема 4. Пример темплатного синтеза, в ходе которого образуется координационное соединение
из 3d-металла с циклическим тетрамером 2-аминобензальдегида.Третий химик, заслуживающий упоминания в связи с нашим повествованием, - Э.Егер (Германия). Он “сварил” хелаты Ni(II) и Cu(II) с тетрадентатным лигандом (схема 5) при взаимодействии ряда замещенных бисацетилацетонэтилендиамина с 1,2-этилендиамином в присутствии солей указанных металлов. Примечательно, что ни одно из этих замещенных с 1,2-этилендиамином не реагирует.
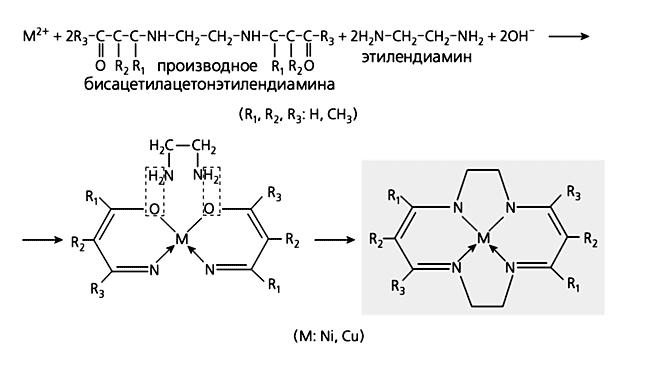
Схема 5. Реакция образования хелатов никеля и кобальта, проведенная Э.Егером.Есть еще одна любопытная черта каждой из упомянутых реакций: того лиганда, который находится во внутренней координационной сфере сформировавшегося хелатного комплекса, среди исходных веществ не было - он образовывался из более простых химических соединений, причем в присутствии конкретного иона металла. И синтез металлохелатов был осуществлен не по классической схеме ион металла + лиганд ® комплекс, а по схеме ион металла + + “осколки” лиганда ® комплекс, да к тому же из “осколков”, которые вроде бы и склеить-то друг с другом никак нельзя. Химики-органики давно уже научились получать соединения исключительной структурной сложности в реакциях сочетания. Так что не выглядит слишком необычной идея использовать аналогичный по сути прием и для получения координационных соединений, в ходе которого органический лиганд образуется прямо в процессе синтеза самого комплекса из более простых строительных блоков. Довольно скоро стало ясно: природа иона металла оказывает подчас решающее влияние не только на характер продуктов подобных реакций, но и на возможность их осуществить.
Ни один из упомянутой троицы не знал кого-либо из двух других, но каждый из них, похоже, быстро уловил, что наткнулся - хоть и случайно - на настоящую золотую жилу. Неудивительно, что все они независимо друг от друга с удвоенной энергией продолжили исследования в этом сразу ставшим перспективным направлении химического синтеза и к настоящему времени опубликовали весьма значительное количество работ. Ну, а кульминацией истории стал 1987 г., когда трем виднейшим специалистам по данной проблеме - правда, не упомянутой троице, а Ж.-М.Лену, Ч.Пердерсену и Д.Краму - была присуждена высшая научная награда, Нобелевская премия.
Для открытого упомянутыми первопроходцами синтетического приема один из них (Буш) уже в 1963 г. предложил специальный термин - темплатный синтез (от англ. template - шаблон, лекало), который быстро приобрел права гражданства и стал общеупотребительным. В настоящее время под ним понимается такой процесс, в котором ион металла не только выполняет функцию комплексообразователя, но и способствует формированию из исходных веществ таких лигандов, чей синтез в его отсутствие затруднен или вообще не возможен. Характерная черта темплатного синтеза в том, что в подавляющем большинстве случаев он сопровождается возникновением дополнительных металлоциклов, а нередко и “сшиванием” их в единый замкнутый контур.
Коль скоро речь зашла о терминологии, упомянем еще три связанных с темплатным синтезом термина, которые нужны будут в дальнейшем изложении. Это лигсон - органическое соединение, выполняющее роль одного из фрагментов (своеобразный строительный блок) при формировании лиганда; темплат - ион металла или другая частица, способная определенным образом ориентировать и подготавливать реакционноспособные лигсоны к последующему их взаимодействию; хелант - лиганд, образующийся при взаимодействии лигсонов. Согласно определению темплатного синтеза, лиганд, входящий в состав образующегося координационного соединения, не должен возникать при непосредственном взаимодействии лигсонов. Следовательно, можно постулировать, что в темплатном процессе вообще и наиболее простом его варианте - в тройных системах (ион металла - лигсон A - лигсон B), в частности, каких-либо реакций между данными органическими соединениями не происходит. Вначале один из лигсонов, например A, с собственным набором донорных атомов, ориентируется определенным образом вблизи иона металла, после чего в дело вступает лигсон B, выполняющий функцию некоего “сшивающего” агента.
Реакции темплатного синтеза можно разделить на три категории. К первой относятся реакции, в ходе которых все донорные атомы, участвовавшие в координировании лигсона A к иону металла, сохраняются в хеланте внутренней сферы металлокомплекса. В реакциях второй категории содержится лишь часть таких атомов, а в третьей они полностью заменяются какими-либо другими. Хотя это деление весьма условно, оно, на наш взгляд, полезно для систематизации подобных процессов, независимо от того, протекают они без изменения степени окисления темплата или она не сохраняется. Нетрудно заметить, что темплатные синтезы Куртиса и Буша подпадают под первую категорию, реакция Егера - под вторую. Те и другие варианты, кстати, весьма распространены, тогда как реакции третьей категории более редки: к ним относится, в частности, процесс, протекающий в системе металл(II)-замещенное ацетилацетона-1,2-фенилендиамин (схема 6).
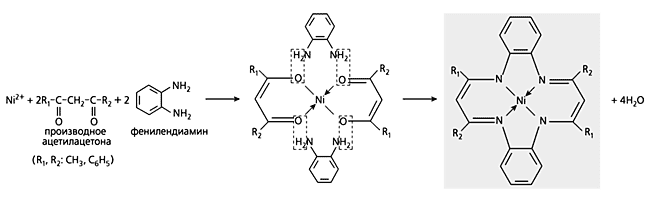
Схема 6. Один из вариантов темплатного синтеза, во время которого донорные атомы кислорода,
участвовавшие в координировании к иону металла, в конечном продукте полностью заменены на атомы азота.Обычно темплатный синтез осуществляется с участием двух лигсонов, однако в строительстве макроциклических соединений могут быть одновременно задействованы три и больше. Пример такого рода - процесс в четверной системе Ni(II)-1,2-этилендиамин-формальдегид-аммиак (схема 7).
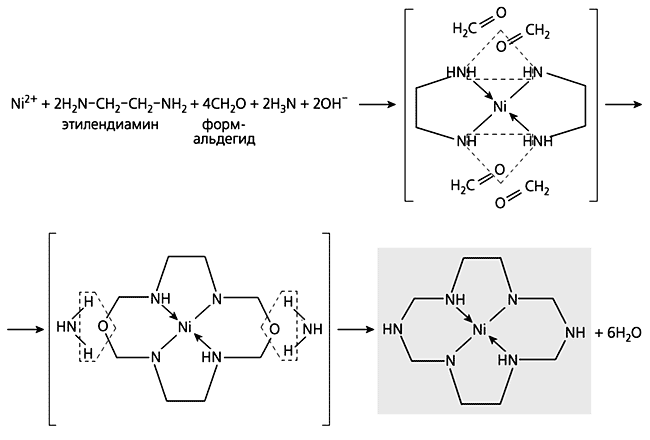
Схема 7. Пример темплатного синтеза с участием трех лигсонов.Описанные здесь темплатные реакции, да и практически все известные, так или иначе связаны с дегидратацией. К числу немногих исключений относится оригинальная реакция синтеза фталоцианина меди(II) (схема 8).
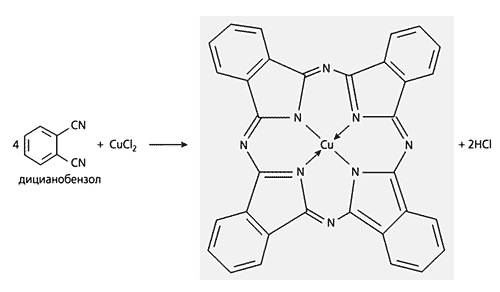
Схема 8. Случай темплатного синтеза в довольно редком варианте - без внутримолекулярной дегидратации.Существует не меньше четырех условий, соблюдение которых обязательно для “соискателей” на роль темплатного центра:
-должны соответствовать друг другу радиусы иона металла-комплексообразователя и внутренней полости, которая возникает в ходе сборки хеланта;Это, так сказать, “геометрические” ограничения. Расчеты показывают, что более других на роль темплатов подходят как раз ионы 3d-элементов, причем в таком порядке “пригодности”: никель(II), за ним медь(II), потом железо(II). Именно они чаще фигурируют в реакциях темплатного синтеза.-количество донорных атомов внутри полости должно соответствовать координационному числу данного иона металла;
-донорные атомы должны располагаться в полости так, чтобы мог образоваться оптимальный координационный полиэдр этого иона;
-хелант должен обладать конформационной гибкостью, за счет которой при минимальной затрате энергии донорные атомы ориентировались бы внутри полости так, чтобы выполнялось предыдущее условие.
Поскольку в большинстве случаев в полости хеланта находятся четыре донорных атома и, как минимум, два из них - атомы элементов с высокой электроотрицательностью, можно ожидать, что наиболее подходящими ионами металлов для выполнения функций темплата окажутся так называемые “жесткие” и “умеренно жесткие” кислоты Пирсона*. Для них типичны либо плоская ромбическая, либо тетраэдрическая координация донорных центров лиганда относительно иона металла. В принципе не исключен и вариант октаэдрической координации, при которой “экваториальная плоскость” октаэдра занята донорными центрами хеланта, а “аксиальные” позиции - каких-либо других лигандов. Немаловажное значение имеют, однако, и электронные характеристики центрального иона металла, в частности его эффективный заряд и способность отдавать d-электроны на p-орбиталь лиганда.
* Понятия “жесткие” и “мягкие” кислоты введены Р.Пирсоном для качественной оценки способности ионов металлов образовывать координационные соединения с теми или иными лигандами. К “жестким” кислотам относятся ионы металлов с высоким положительным зарядом, малым размером, слабой поляризуемостью и не имеющие легко возбуждаемых внешних электронов. К “мягким” - ионы металлов с малым положительным зарядом, большим размером, высокой поляризуемостью и имеющие несколько легко возбуждаемых внешних электронов.Однако прогнозирование результатов темплатного синтеза даже с учетом всех упомянутых факторов и по сей день представляет весьма непростую задачу, особенно если не известны сколько-нибудь близкие аналоги процесса. Подчас даже сходные по геометрическим и электронным параметрам ионы, оказываясь в роли темплата, “раскручивают” синтез в совершенно разных направлениях. Бывает даже так, что ион металла, выстроив “хоровод” лигсонов, вдруг неожиданно покидает его.Химики основательно поработали на ниве темплатного синтеза. Уже в 70-80-е годы исследования в данной области координационной химии шли семимильными шагами, а к настоящему времени количество публикаций и разнообразие материала просто не счесть. Все это, однако, касается темплатного синтеза в растворах или твердой фазе, и до наших работ, похоже, никому и в голову не приходила мысль осуществить подобный синтез в каких-то иных условиях. И в самом деле, так ли уж нужно от добра искать добра? Нужно, и вот почему.
При конструировании макроциклических соединений из лигсонов в традиционных условиях (в растворе или твердой фазе) скорость синтеза весьма мала. Поэтому, чтобы получить целевой продукт в заметном количестве, хочешь не хочешь приходится повышать температуру да еще и давление в течение длительного времени. Ясно, что предпочтительнее было бы избегать ужесточения условий синтеза. В связи с этим выглядит заманчивой идея осуществить его в системах, содержащих металл, который иммобилизован в полимерной матрице. В таких системах реакционный объем крайне мал, а подвижность комплексообразователя-“лекала” резко ограничена, что способствует необходимому предварительному снижению энтропии и тем самым существенно облегчает реализацию всех стадий сборки макроцикла. Весьма перспективны иммобилизованные системы, в которых принципиально возможен темплатный синтез, - гексацианоферраты(II) p-, d- и f-металлов, закрепленных в желатиновой матрице. Природному желатину присущи изотропность физико-механических свойств, прозрачность, гидрофильность и пластичность, а иммобилизованным веществам - жесткость фиксации, оптимальная кинетическая лабильность и весьма низкая растворимость в воде. В таких системах темплатный синтез мог бы проходить при контакте упомянутых металлокомплексов с водными растворами лигсонов.
По химической природе желатин - это биополимер, полидисперсная смесь низкомолекулярных полипептидов (молекулярная масса 50-70 кД) или же их агрегатов (200-300 кД). Длина молекул желатина составляет в среднем 2850 Е, а диаметр - всего 14 Е. Они слагаются из трех полипептидных цепей
a-типа почти с одинаковой молекулярной массой, которые свиваются в спираль. Существенную роль в ее стабилизации играют водородные связи. В результате образуется совокупность длинноцепных молекул, соединенных между собой ограниченным числом поперечных сшивок. Такая структура весьма удобна в качестве матрицы для иммобилизации, так как она, с одной стороны, не позволяет образоваться каким-либо жестким кристаллическим блокам, с другой - обладает достаточно большим количеством ячеек для размещения в них молекул иммобилизуемого вещества. Средний размер межмолекулярных пустот в желатине составляет порядка 80-90 Е, так что в каждой такой среднестатистической пустоте может разместиться до нескольких десятков элементарных ячеек того или иного гексацианоферрата(II). Сами же ячейки, уже заполненные молекулами химического соединения, сохраняют определенную свободу перемещения в пространстве. Вот почему матричные системы на основе желатина характеризуются наноструктурной организацией, довольно однородным распределением иммобилизованного вещества и хорошей стерической доступностью молекул для осуществления различных химических процессов и темплатного синтеза тоже. Кроме того, желатин, будучи амфолитом, в щелочной среде приобретает избыточный заряд. Это чрезвычайно важно, поскольку, как упоминалось, большинство реакций темплатного синтеза связано с дегидратацией и, следовательно, с участием подвижных протонов. Оно в свою очередь обусловлено протонодонорной способностью лигсона (надо ли говорить, что она повышается в среде молекул, несущих отрицательный заряд).
Первой парой лигсонов, которые мы использовали для проверки возможности темплатного синтеза в нетрадиционных условиях, были дитиооксамид H2N-C(=S)-C(=S)-NH2 и формальдегид H2C=O. Дитиооксамид, содержащий подвижные протоны (несмотря на это его никогда не использовали в таком синтезе), не взаимодействует с формальдегидом по крайней мере при T<350 К. Поэтому, если в системе из дитиооксамида, формальдегида и какого-либо иона металла образуется комплексное соединение, в построении молекулы которого принимают участие оба эти вещества, правомерно квалифицировать процесс как темплатный синтез. Однако при комнатной температуре и даже при нагревании ни в растворе, ни в твердой фазе такой синтез не возможен, возникает только комплекс иона металла с одним лишь дитиооксамидом. Но вот если желатиновую матрицу с иммобилизованным гексацианоферратом(II) кобальта, никеля или меди обработать водно-щелочным (pH~12) раствором упомянутой пары лигсонов (в соотношении 1:2), синтез протекает уже при температуре 20-25°С, и повышенного давления не требуется! В результате образуются металлмакроциклические соединения (схема 9, а).
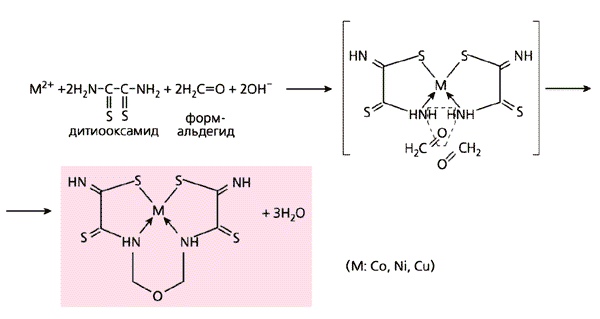
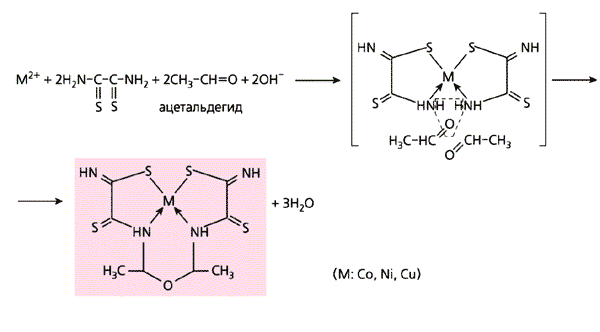
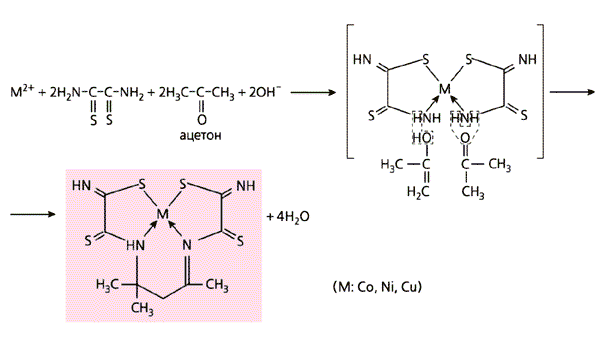
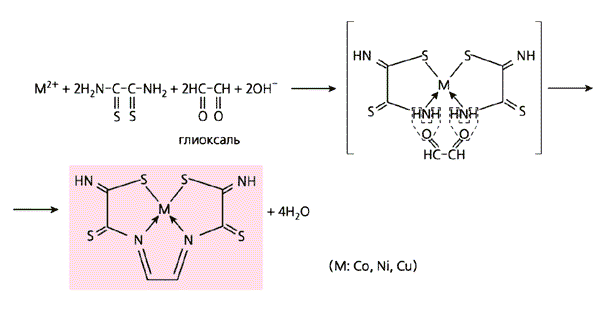
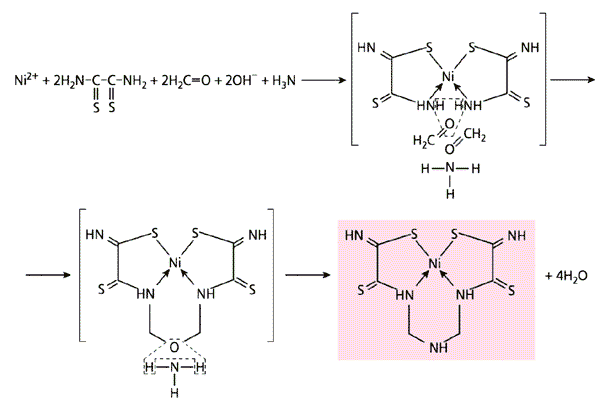
Схема 9. Примеры темплатного синтеза, проведенного в желатиновой матрице
с иммобилизованным гексацианоферратом(II) кобальта, никеля или меди.
В качестве лигсонов использованы разные соединения.Аналогичен синтез и в том случае, если в паре с дитиооксамидом вместо формальдегида участвует какой-либо из его ближайших “родственников”: ацетальдегид H3C-HC=O, ацетон H3C-C(=O)-CH3 или же простейший диальдегид - глиоксаль (схемы 9, б-г).
Недавно в желатиновой матрице с иммобилизованным гексацианоферратом(II) никеля Ni2[Fe(CN)6] нами осуществлен темплатный синтез в четверной системе Ni(II)-дитиооксамид-формальдегид-аммиак (схема 9, д). Перечень систем, в которых нам удалось реализовать темплатный синтез, используя желатиновую матрицу с иммобилизованными в ней гексацианоферратами(II) этих трех металлов, перечисленным далеко не ограничивается. И претендентов на роли лигсонов не счесть.
Здесь обрисованы лишь основные контуры темплатного синтеза - одного из актуальнейших научных направлений современной координационной химии. Да и примеры ограничены только реакциями, которые приводят к образованию моноядерных и монолигандных комплексов. Подобный синтез с успехом применяется для получения гетероядерных и гетеролигандных кластерных, палубных, катенановых и прочих супрамолекулярных координационных соединений. В некоторых из них ионы металлов фактически “закапсулированы” в полостях хелантов настолько, что извлечь их оттуда без полного разрушения всего соединения невозможно.
От первых склеенных “химических кувшинов” до современных супрамолекулярных соединений пройден не один шаг, и каждый был весьма продуктивным. Полученные в результате темплатного синтеза макроциклические соединения, содержащие металл, олицетворяют собой своеобразную “пограничную зону” между неорганической и органической химией. Потому вполне естественно, что таким “темплатным” комплексам присущ ряд специфических свойств, которые обеспечат им самые разные области практического применения. Некоторые иммобилизованные на поверхности хелаты 4f-элементов, например, обладают уникальными люминесцентными свойствами и могут быть использованы в качестве биологических меток. За счет “капсулирования” ионов металлов и образования “клеточной” структуры во многих случаях резко повышается термостабильность координационных соединений и существенно увеличивается их способность к летучести без разложения. Благодаря этому они становятся пригодными для получения металлических и металлоксидных пленок. Полиядерные макроциклические хелаты с вакантными полостями оказались весьма перспективными для изготовления так называемых молекулярных переключателей, а гетероядерные комплексы - для запоминающих устройств. То и другое применение обусловлено своеобразным внутримолекулярным переносом ионов из полости в полость, изменением заряда центрального иона металла без разрушения структуры комплекса, в результате чего ион выполняет роль своеобразного медиатора внутримолекулярных редокс-процессов. Из макроциклических хелатов с длинноцепочечными заместителями можно получать жидкокристаллические системы. Некоторые комплексы, прежде всего содержащие Co(II), оказались эффективными переносчиками электронов в фотокаталитическом разложении воды с выделением водорода. Заманчиво использовать такие хелаты как фотосенсибилизаторы в фотохимических процессах трансформации кислорода в пероксид водорода. Недавно предложены радиотерапевтические препараты на основе макроциклических азотборсодержащих комплексов Tc(III), позволяющие эффективно доставлять радиоактивный технеций в пораженную раковой опухолью зону организма. Координационные соединения ряда 3d-элементов могут быть использованы в качестве носителей фотографических изображений… Как видно из сказанного, перечень возможных точек практического приложения подобных соединений весьма разнообразен. Да и сама эта область химической науки таит в себе еще много неожиданного и интересного.