том 73, № 2, с. 117-127 (2003)
| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 73, № 2, с. 117-127 (2003) |
Ниже публикуется статья лауреата Большой золотой медали им. М.В. Ломоносова 2002 г., которая написана на основе доклада, прочитанного 15 мая 2002 г. на Общем собрании Российской академии наук при вручении этой награды.РИБОНУКЛЕИНОВЫЕ КИСЛОТЫ
КАК ЦЕНТРАЛЬНОЕ ЗВЕНО ЖИВОЙ МАТЕРИИА. С. Спирин
Спирин Александр Сергеевич - академик, советник РАН.В 30-х годах прошлого столетия моему учителю Андрею Николаевичу Белозерскому удалось поставить последнюю точку в затянувшихся спорах о принадлежности двух разных типов нуклеиновых кислот - рибонуклеиновой (РНК) и дезоксирибонуклеиновой (ДНК) - растительному или животному царствам живого мира. Тогда о генетических функциях обеих нуклеиновых кислот еще ничего не знали. Долгое время РНК считалась компонентом растений, включая грибы, а ДНК рассматривалась как типичный компонент животных клеток, как "животная нуклеиновая кислота", чаще всего называвшаяся тогда "тимонуклеиновой кислотой" (от thymus - латинского названия зобной железы, из которой ее выделяли). Затем оказалось, что РНК, наряду с ДНК, широко распространена у животных. Однако относительно наличия ДНК в растительных клетках существовали большие сомнения: прямых данных не было, а единственное косвенное указание - положительная цветная цитохимическая реакция Фейльгена, которую обнаруживали ядра растительных клеток, - не могло считаться надежным свидетельством. А.Н. Белозерским был сначала выделен и идентифицирован тимин - самый характерный компонент ДНК - из семян гороха [1], а затем сама ДНК была препаративно выделена из семян конского каштана [2]. Так установилось окончательное понимание того, что и РНК, и ДНК - два универсальных типа нуклеиновых кислот, присущих всем царствам живого мира.
В 40-х годах на основе различных цитологических и биохимических наблюдений и анализов стало складываться представление, что ДНК, постоянно локализующаяся в ядрах клеток, в их хромосомах, самым тесным образом связана с аппаратом наследственности, а РНК - это обязательный компонент клеточной цитоплазмы, ответственный за биосинтез белка [3, 4]. Прямые эксперименты Т.Эйвери с сотрудниками [5] доказали, что чистая, изолированная ДНК может быть носителем наследственных признаков организма. (Более подробно об этих экспериментах, а также о составе и строении ДНК см. в обзоре [6]). Все большее число исследователей, в первую очередь биохимиков и цитологов, начинали склоняться к мысли, что ДНК или ее комплексы с белками могут быть основными носителями генетической информации, а РНК - посредником, воспринимающим эту информацию от ДНК и реализующим ее в виде биосинтеза белков.
Рис. 1. Полинуклеотидные цепи
нуклеиновых кислот ДНК и РНК (фрагменты)К началу 50-х годов Э. Чаргафф установил факт видовой специфичности состава ДНК, показав, что соотношения четырех сортов ее мономеров - гуанилового (G), аденилового (А), цитидилового (С) и тимидилового (Т) - различаются у разных видов организмов [7, 8]. Этот факт прямо соответствовал предполагавшейся генетической роли ДНК. При этом были найдены также удивительные закономерности в нуклеотидном составе ДНК, названные "правилами Чаргаффа": независимо от видовых различий, во всех ДНК количество G было равно количеству С, а количество А -количеству Т (G = С, А = Т). В 1953 г. Дж. Уотсон и Ф. Крик, используя эти экспериментальные данные по химическому составу ДНК, а также результаты рентгеноструктурных анализов ориентированных нитей ДНК, указавших на спиральный характер укладки полимерных молекул ДНК [9, 10], предложили модель макромолекулярной структуры ДНК [11]. Это была двойная спираль, где две полимерные нити ДНК закручены друг относительно друга вокруг общей оси и удерживаются вместе за счет парных взаимодействий G с С и А с Т. Их догадка оказалась гениальной: непосредственно из структуры вытекал механизм ее точного воспроизведения [12], что впервые дало объяснение воспроизведению себе подобных структур в процессах размножения и наследственности. Так полвека назад родилась новая наука - молекулярная биология.
Рис. 2. Репликация РНК на матрице ДНК (транскрипция) Естественно, что молекулярная биология началась с эры ДНК. ДНК была провозглашена "главной молекулой жизни", "нитью жизни", началом начал и основой всего живого. Белки, ранее рассматриваемые как основной компонент живых систем, теперь "увольнялись" со всех руководящих позиций и "назначались" на второстепенные роли катализаторов, обслуживающих существование ДНК. Роль другого типа нуклеиновых кислот - РНК - сводилась к функции посредников, производимых на матрицах ДНК и направляющих синтез белков. Схема "ДНК—>РНК —> белок" с необратимостью процессов передачи информации, обозначаемых стрелками, получила название "центральной догмы молекулярной биологии" (подробнее см. [6,13]).
Рис. 3. Корреляция нуклеотидного состава РНК
с нуклеотидным составом ДНК [15]РНК: РЕПЛИКАЦИЯ НА ДНК И ГЕНЕТИЧЕСКАЯ ФУНКЦИЯ
В основе воспроизведения (репликации) структуры ДНК лежит так называемый принцип комплементарности: в двойной спирали две полимерные цепи ДНК связаны бок о бок водородными связями за счет образования пар G-C, C-G, А-Т и Т-А (см. [6], рис. 2 и 3). Если две цепи двойной спирали расходятся, то на каждой из них может строиться (полимеризоваться) новая комплементарная цепь, так что напротив G исходной цепи установится С новой цепи, напротив С старой цепи - G новой цепи, напротив А-Т, а напротив Т-А; в результате получатся две дочерние двойные спирали, полностью идентичные исходной - материнской (см. [6], рис. 4).
РНК химически подобна ДНК. В обоих случаях это линейные, неразветвленные полимеры нуклеотидов с пентозо-фосфатным остовом и четырьмя типами азотистых (пуриновых и пиримидиновых) оснований в качестве боковых групп (рис. 1). Существует только два небольших отличия цепи РНК от одиночной цепи ДНК:
1) пятиуглеродный сахар (пентоза) в РНК представлен рибозой, а в ДНК - его производным 2'-дезоксирибозой;Тот же вышеупомянутый принцип комплемен-тарности обеспечивает механизм репликации РНК на матрице ДНК. Разница лишь в том, что РНК полимеризуется только на одной из двух разошедшихся цепей двойной спирали ДНК (рис. 2). Разумеется, при синтезе РНК напротив А цепи ДНК становится уридиловый рибонуклеотид (U) вместо тимидилового дезоксирибонуклеотида (Т) при синтезе ДНК. Реплицирующаяся цепь РНК, таким образом, является точной копией противоположной цепи ДНК, с заменой Т на U. Процесс репликации сопровождается отделением цепи РНК от ДНК. В результате такой репликации РНК образуется как гибкий одноцепочечный полимер в отличие от жесткой двойной спирали ДНК.2) один из двух пиримидиновых нуклеотидов в РНК представлен уридиловым остатком (U) вместо его метилированного производного Т в ДНК.
Будучи копиями определенных функциональных отрезков цепи ДНК - генов, цепи РНК призваны служить матрицами для синтеза другого типа полимеров - полипептидных цепей белков. Так как белки состоят из двадцати разных сортов мономеров (аминокислот), а РНК - только из четырех сортов мономеров (нуклеотидов), детерминация аминокислотной последовательности полипептидной цепи нуклеотидной последовательностью РНК требует того, чтобы каждая аминокислота кодировалась комбинацией из нескольких - не менее трех - нуклеотидов. Именно триплетный код был сначала постулирован на основании теоретических соображений, а затем и доказан экспериментально. За РНК прочно закрепилась генетическая роль посредника между генами и белками: с одной стороны, РНК представлялась как совокупность копий генов, то есть копий отрезков ДНК, а с другой - как непосредственные матрицы, последовательности нуклеотидных триплетов которых декодируются в аминокислотные последовательности полипептидных цепей в процессе синтеза белков.
Исходя из этих представлений, в 1956 г. мной, тогда аспирантом А.Н. Белозерского в Институте биохимии АН СССР, была начата работа по экспериментальной проверке соответствия ДНК и РНК. Сначала мы показали, что нуклеотидный состав (соотношение четырех сортов нуклеотидов) ДНК может очень сильно различаться у разных видов организмов, в частности у бактерий разных таксономических групп. Далее мы исходили из того, что если РНК - копия ДНК, то нуклеотидный состав этих двух типов нуклеиновых кислот должен совпадать или, по крайней мере, быть сходным. Наши анализы дали совершенно неожиданный результат: при сильных вариациях состава ДНК соотношения нуклеотидов в тотальной РНК разных видов оказались удивительно консервативны (табл.) [14]. Вместе с тем статистический анализ этих данных показал, что имеется надежная положительная корреляция состава РНК с составом ДНК, хотя и при малой величине регрессии (рис. 3) [15]. Данные были интерпретированы так, что на фоне основной массы эволюционно консервативной, похожей у разных видов РНК существует относительно малая фракция видоспецифической РНК, копирующей ДНК.
В 1959 г. Ф. Крик так описал этот ранний период истории молекулярной биологии:
"Проблема кодирования прошла к настоящему времени три фазы. На первой - фазе блужданий - были сделаны различные предположения, но ни одно не было достаточно точным, чтобы подвергнуться опровержению. Вторая фаза - оптимистическая - была инициирована в 1954 году Гамовым, который был достаточно смелым, чтобы предложить довольно точный код. Это стимулировало целый ряд исследователей, стремившихся показать, что его предположения неверны, и тем самым они несколько подняли точность мышления в этой области. Третья фаза - фаза замешательства - была инициирована статьей Белозерского и Спирина в 1958 году... Данные, представленные там, показывали, что наши представления по многим важным аспектам были чересчур упрощенными" [16].Таким образом, в работе 1956-1958 гг. нами были получены указания на два новых обстоятельства: во-первых, на наличие в клетках основной массы РНК, не являющейся посредником между генами и белками, то есть, по-видимому, негенетической РНК, и, во-вторых, на существование ДНК-подобной - генетической - РНК в виде сравнительно небольшой фракции, которой и могла быть приписана роль посредника между генами и белками.Несколько ранее было установлено, что ДНК-подобная РНК образуется при заражении бактерий вирусом (бактериофагом): внедрение нового генетического материала - ДНК вируса - в клетку индуцировало синтез РНК, подобной по составу вирусной ДНК и, очевидно, определяющей синтез вирусных белков [17]. В нашей работе было впервые показано, что фракция ДНК-подобной РНК есть нормальный компонент обычных, не зараженных клеток, где она, по-видимому, выполняет функцию переноса генетической информации от своей ДНК, чтобы определять синтез своих белков. Позднее эта фракция РНК получила название messenger RNA [18], матричной РНК (мРНК), или информационной РНК.
Дальнейшие исследования мРНК в моей группе (с 1960 г. - лаборатории) в Институте биохимии АН СССР и переход от изучения микроорганизмов к высшим организмам привели еще к одному открытию. Оказалось, что в клетках высших организмов - животных и высших растений - мРНК в свободном виде не существует, она представлена в виде рибонуклеопротеидных частиц (мРНП-частиц), названных нами информосомами [19, 20].
Этот новый тип внутриклеточных частиц характеризовался рядом уникальных физико-химических свойств, и в частности, постоянным соотношением структурного белка и мРНК со значительным преобладанием белкового компонента. Роль нуклеопротеидной формы существования мРНК в клетках высших организмов в дальнейшем изучалась многими исследователями в связи с механизмами регуляции белкового синтеза на уровне трансляции. Эти работы дали ключ к пониманию ряда молекулярных механизмов оогенеза, сперматогенеза и раннего эмбриогенеза, клеточной дифференцировки и морфогенеза, эритропоэза и других процессов в жизнедеятельности многоклеточных существ, включая человека (см. обзоры [21, 22]).
СТРУКТУРНАЯ РНК
После 1958 г. главные усилия моей группы были направлены на изучение консервативной, негенетической РНК, составляющей основную часть тотальной клеточной РНК. Быстро выяснилось, что преобладающая ее часть (около 90%) представляет собой компонент рибосом - внутриклеточных рибонуклеопротеидных частиц, являющихся молекулярными "фабриками" по производству белков. В серии блестящих работ английских, французских и американских исследователей [23-25] было доказано, что рибосомы и РНК рибосом сами не несут генетической информации для синтеза белков, а служат универсальным, неспецифическим аппаратом, который должен быть программирован информационной РНК (мРНК), чтобы синтезировать специфические, детерминированные соответствующими генами белки.
Первые же исследования рибосомных РНК в нашей лаборатории показали, что это - крупные макромолекулы (молекулярный вес порядка 106), каждая из которых представляет собой одну ковалентно-непрерывную полинуклеотидную цепь [26, 27] в противоположность выдвинутому ранее представлению о субъединичном характере строения молекул рибосомных РНК [28]. Несколько ранее при изучении высокополимерной биологически активной (инфекционной) РНК из вируса табачной мозаики нам удалось обнаружить ее способность к формированию вторичной и третичной структур, то есть к складыванию и сворачиванию ее полинуклеотидной цепи в структуры с ближними и дальними внутрицепными взаимодействиями [29,30]. Подобное же поведение оказалось возможным продемонстрировать и в случае рибосомных РНК в растворе [26, 27]. В совокупности исследования физико-химических свойств и структурных характеристик изолированных высокополимерных РНК в растворе, выполненные в 1958-1962 гг., привели к формулированию следующих общих принципов их пространственной организации:
• РНК, в отличие от ДНК, - одноцепочечный полимер',Принцип формирования компактных структур высокополимерными РНК получил подтверждение и дальнейшее развитие в цикле работ Института белка АН СССР, организованного мной и моими коллегами в 1967 г. в Пущине. В электронно-микроскопических исследованиях рибосомных РНК, проведенных В.Д. Васильевым совместно с сотрудниками моей лаборатории, было впервые продемонстрировано, что в соответствующих условиях РНК образуют компактные частицы, специфические по форме, в зависимости от типа РНК, и форма компактно свернутой РНК определяет общую морфологию рибосомной частицы [31, 32]. Рибосома включает два типа высо-кополимерных РНК: так называемую 16S, или малую рибосомную РНК (мол. вес около 0.6 х 106), и 23S, или большую рибосомную РНК (мол. вес около 1.2 х 106). Каждая из них, совместно с рибосомными белками, входит в состав двух разных по размеру и форме рибонуклеопротеидных частиц, называемых рибосомными 30S и 50S субъединицами. Объединившись (ассоциация рибосомных субъединиц), эти две частицы образуют полную функциональную рибосому. Электронная микроскопия показала, что 16S и 23S РНК, без всяких белков, сами организуют свое сворачивание в компактные частицы специфической формы, похожие на соответствующие рибосомные субъединицы (см. [13], рис. 4). Отсюда следовал принципиально важный вывод о структурообразующей функции РНК. Ранее и способность к специфическому самосворачиванию в компактные глобулы, и функции структурообразования внутриклеточных частиц приписывались только белкам.• РНК формирует вторичную структуру — набор коротких спиральных участков - в основном за счет антипараллельного комплементарного спаривания смежных отрезков цепи;
• РНК способна образовывать третичную структуру за счет дальних комплементарных взаимодействий внутри цепи и межспиральных взаимодействий;
• высокополимерная РНК способна сворачиваться в компактные частицы;
• РНК обладает значительной конформационной подвижностью (рис. 4).
Этим наблюдениям предшествовали наши опыты по индуцированным структурным превращениям рибосом типа разворачивания рибосомных частиц в рибонуклеопротеидные тяжи без потери рибосомных белков [33, 34], а также разборки и обратной самосборки рибосомных белков на ядре РНК (реконструкции рибосом) [35], доказавшие, что при формировании рибосомных частиц РНК служит каркасом. Изучение нейтронного рассеяния рибосом совместно с группой И.Н. Сердюка в Институте белка АН СССР (см. [32]) дало дополнительные физические свидетельства о взаимном расположении РНК и белков в рибосомных частицах. В целом все это позволило сформулировать три общих принципа структуры рибосом:
• рибосома построена из двух неравных разделяемых субчастиц - малой и большой рибосомных субъединиц;Рибосомы и их обе субъединицы были успешно кристаллизованы нами в Институте белка и совместной немецко-израильской группой (Г. Виттманн -ФРГ и А. Йонат - Израиль) еще в 80-х годах, после чего в нескольких лабораториях началось кристаллографическое рентгеноструктурное исследование с целью расшифровки их атомной структуры. В 1999-2001 гг. структура бактериальной рибосомы и ее субъединиц была определена с разрешением от 5.5 до 2.4 А в зависимости от объекта исследования американскими, английской и немецко-израильской группами исследователей [36-39].• две специфически самосворачиваемые высокополимерные РНК - рибосомные РНК - образуют компактные структурные ядра двух рибосомных субъединиц;
• разнообразные рибосомные белки и их группы специфически собраны на каркасе рибосомных РНК, в основном на периферии этих компактных ядер.
Помимо информации о детальном устройстве рибосомы, полученные результаты полностью подтвердили вышеуказанные общие принципы ее структуры, и в первую очередь тот факт, что форма субъединиц определяется их компактно свернутой РНК, а рибосомные белки располагаются на периферии этих ядер. Полная рибосома - ассоциат двух разных, компактно и специфически свернутых РНК, лишь на части поверхности "декорированной" белками. Важно, что именно рибосомная РНК, как оказалось, образует главные функциональные центры рибосомы и определяет принципиальное устройство рибосомы как молекулярной машины, осуществляющей синтез белка по программе, записанной в мРНК. Вполне вероятно, что на заре жизни рибосома состояла только из РНК, а рибосомные белки - это более позднее эволюционное приобретение для стабилизации рибосомной РНК или улучшения ее функции.
ВСЕМОГУЩАЯ РНК
Способность РНК к формированию компактных трехмерных структур, как и в случае белков, дает основу для специфического взаимодействия с другими молекулами - макромолекулами и малыми лигандами. Для молекул РНК, свернутых в специфическую глобулу, благодаря чему на ее поверхности создается уникальный пространственный узор, приходится допустить возможность функции молекулярного узнавания, как и у белков. В свою очередь, высокоизбирательное узнавание приводит к возможности специфического катализа химических реакций на манер ферментативного катализа реакций белками.
Пожалуй, первыми известными "узнающими" РНК можно считать так называемые "транспортные" РНК, или тРНК, выполняющие адапторную роль в биосинтезе белка (см. [13], рис. 1). Эти сравнительно небольшие РНК (мол. вес около 30000) представляют собой компактно свернутые молекулы с однотипной пространственной структурой (см. [13], рис. 3). Их назначение - перенос аминокислот из свободного состояния в состав синтезируемой рибосомой полипептидной цепи белка. Для выполнения этой задачи тРНК должна поочередно и очень избирательно взаимодействовать с целым рядом макромолекулярных структур в клетке: сначала с белком-ферментом (аминоацил-тРНК-синтетазой), несущим определенную активированную аминокислоту, затем, неся на себе ковалентно присоединенную аминокислоту, с другим белком (фактором элонгации EF-Tu), вместе с которым она поступает в рибосому, и потом одновременно с рибосомной РНК и мРНК в рибосоме. Хотя на этом пути, несомненно, реализуются функции специфического узнавания молекулами тРНК других макромолекул, долгое время все же молчаливо принималось, что основную роль играет узнавание тРНК со стороны белков - ферментов, факторов трансляции и рибосомных белков, но не наоборот.
Английский ученый Э. Кандлифф был первым, кто четко и определенно заявил о способности структурированных участков рибосомной РНК специфически узнавать малые лиганды ненуклеиновой и небелковой природы. Он представил экспериментальные данные в пользу избирательного взаимодействия (связывания) именно участков свернутой РНК, а не белков, с рядом антибиотиков рибосомного действия - тиострептоном, эритромицином, аминогликозидами (стрептомицином, канамицином, неомицином) [40]. Через 10 лет другими учеными были представлены прямые структурные данные о специфическом связывании аминогликозидных антибиотиков районом малой (16S) рибосомной РНК [41] (см. также обзор [42]).
Окончательное признание за РНК способности узнавать самые разнообразные молекулы и весьма специфично взаимодействовать с ними пришло благодаря аптамерам - небольшим по размерам синтетическим РНК, получаемым путем отбора из многих вариантов нуклеотидных последовательностей с помощью процедур так называемой "бесклеточной эволюции", "эволюции в пробирке" [43, 44]. Оказалось, что можно отобрать и размножить РНК, обладающие способностью избирательно связывать практически любой вид молекул, начиная от низкомолекулярных органических соединений и кончая различными индивидуальными пептидами и белками (см. обзоры [42, 45]). Другими словами, РНК, как и белки, действительно в полной мере могут обладать функцией специфического молекулярного узнавания.
Еще до этих исследований, в начале 80-х годов прошлого века, в лабораториях Т. Чека и С. Олтмана в США было сделано сенсационное открытие, осуществившее революцию в биохимии и молекулярной биологии: было показано, что РНК может быть специфическим катализатором биохимических реакций [46,47]. В течение всей предшествующей истории биохимии на протяжении десятилетий утверждалось, что биохимический катализ - "прерогатива" исключительно белков-ферментов. Поэтому и все теории происхождения жизни вынуждены были исходить из первичности белков как макромолекул, абсолютно необходимых для возникновения биохимического метаболизма (обмена веществ). Открытие каталитической функции РНК перевернуло все прежние представления об исключительной роли белков не только в возникновении жизни, но и в понимании самого явления жизни.
По аналогии с белками-ферментами - энзимами - каталитические РНК были названы рибозимами. По-видимому, почти все рибозимы, естественно существующие в живой природе в клетках современных организмов, так или иначе участвуют в процессах, связанных с превращениями полинуклеотидных цепей самих РНК. Однако оказалось возможным создавать и искусственные рибозимы с более широким спектром катализируемых реакций [48]. Кроме того, как выясняется из всей совокупности данных по структуре рибосом и особенностей катализируемой рибосомой реакции образования пептидных связей в процессе биосинтеза белка, каталитический центр этой реакции (пептидил-трансферазный центр рибосомы) формируется определенным доменом большой рибосомной РНК, без принципиального участия рибосомных белков, то есть имеет рибозимную природу [49,50].
Итак, именно после открытия каталитической функции РНК поменялась парадигма, и взоры биологов обратились к РНК. В самом деле, молекулы РНК способны делать все то, что делают белки: складываться в специфические структуры и определять формообразование биологических частиц, с большой точностью узнавать другие макромолекулы и малые лиганды и взаимодействовать с ними, наконец, осуществлять катализ ковалентных превращений узнаваемых молекул. Конечно, белки делают все это более эффективно и разносторонне, чем РНК. Но зато белки в принципе "не умеют" самовоспроизводиться - не существует никаких собственных белковых механизмов для воспроизведения их структуры, кроме как через РНК. В то же время РНК содержит все необходимые структурные предпосылки для точного воспроизведения ее собственной структуры.
РНК - близкий аналог ДНК, современного "вещества наследственности". Структурно ничто не мешает ей образовывать двойные спирали по типу ДНК, с полным соблюдением принципа комплементарности за счет формирования пар G-C, C-G, A-U и U-A между двумя полирибонуклеотидными цепями. В таком случае и воспроизведение (репликация) РНК на РНК представляется вполне разрешенным процессом. Действительно, хорошо известно, что двойные спирали РНК существуют в природе, и в первую очередь - в качестве самостоятельных РНК-геномов у некоторых вирусов (например, реовирусов и ротавирусов животных и человека). Вообще геномы в виде РНК, а не ДНК довольно распространены среди вирусов как животных, так и растений, а также бактериальных вирусов (бактериофагов), но в подавляющем большинстве случаев их геномная РНК представлена одной цепью РНК, на которой лишь после попадания вируса в клетку строится комплементарная цепь.
Так или иначе, вирусология давно доказала наличие таких же генетических репликативных функций у РНК, какие свойственны ДНК в клеточных организмах.
По-видимому, современные клеточные организмы не могли бы существовать без генетического "единоначалия" ДНК, и на самостоятельное воспроизведение РНК эволюцией был наложен строгий запрет, иначе происходила бы дерегуляция генной активности в организмах, нарушение контролируемого генами баланса продуктов и процессов в клетке и полная дезорганизация жизни. Тем не менее репликация РНК на РНК в специальных случаях может осуществляться в нормальных клетках. Об этом свидетельствуют самые последние открытия новых классов малых негенетических РНК в клетках животных и растений - так называемых интерферирующих РНК (siRNA) и микpoPHK (miRNA) — с регуляторной и антивирусной активностью: функционирование и воспроизведение этих РНК требует их самостоятельной репликации [51].
МИР РНК - ДРЕВНИЙ И СОВРЕМЕННЫЙ
Таким образом, РНК представляется наиболее самодостаточным веществом живой материи. Она принципиально способна выполнять все или почти все функции, которые свойственны белкам, включая формообразование и биохимический катализ, и в то же время может быть полноценным генетическим веществом с его репли-кативной и кодирующей функциями [13]. Осознание этих фактов и привело биологов, химиков и геологов к гипотезе о древнем "мире РНК", который эволюционно предшествовал нашей нынешней ДНК-РНК-белковой жизни [52] (подробнее см. [13]). В мире РНК не было ни белков, ни ДНК, а лишь ансамбли различных молекул РНК, выполняющих разные вышеперечисленные функции. Это были, скорее всего, бесклеточные системы. Формирование клеточных структур, безусловно, требует участия, по крайней мере, белков и липидов, которых еще не было. Компартментализация ансамблей РНК в виде коацерватных капель также была маловероятна, по причине отсутствия полипептидов, полисахаридов и других полимеров, способных к коацервации. Тем не менее, для того чтобы каждый ансамбль РНК мог существовать как система, наследовать приобретенные признаки, полезные для всей системы, и эволюционировать, его РНК-репликазы, лиганд-связывющие РНК, РНК-синтетазы и продукты синтезов должны быть, очевидно, как-то объединены в пространстве. Поэтому в большинстве теорий происхождения жизни возникновение ограничивающих мембран или хотя бы поверхностей раздела фаз постулируется необходимым условием начала эволюции, в том числе эволюции ансамблей РНК (например, см. [53]).
Возможна, однако, и альтернатива, на мой взгляд, даже более вероятная. Около десяти лет назад в Институте белка РАН моим учеником А.Б. Четвериным с сотрудниками была экспериментально показана способность молекул РНК формировать молекулярные колонии на гелях или других твердых средах, если на этих средах им были предоставлены условия для репликации [54,55] (рис. 5). Смешанные колонии РНК на твердых или полутвердых поверхностях и могли быть первыми эволюционирующими бесклеточными ансамблями, где одни молекулы выполняли генетические функции (репликацию молекул РНК всего ансамбля), а другие формировали необходимые для успешного существования структуры (например, такие, которые адсорбировали нужные вещества из окружающей среды) или были рибозимами, ответственными за синтез и подготовку субстратов для синтеза РНК. Такая бесклеточная ситуация создавала условия для очень быстрой эволюции: колонии РНК не были отгорожены от внешней среды и могли легко обмениваться своими молекулами - своим генетическим материалом. Легкое распространение молекул РНК через среду, в том числе атмосферную, также было продемонстрировано в прямых экспериментах [54]. Более того, как показали недавние эксперименты той же группы исследователей, молекулы РНК при столкновениях в водной среде могут спонтанно обмениваться кусками, то есть обладают способностью к неэнзиматической рекомбинации [56].
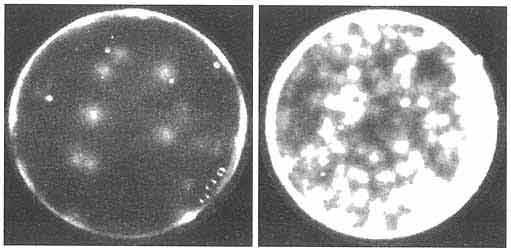
Рис. 5. Колонии реплицирующихся молекул РНК на агарозном геле [54, 55]
Слева - колонии РНК, выросшие на закрытой чашке Петри
в течение одного часа при температуре 25°С.
Справа - колонии РНК выросшие на открытой чашке Петри в тех же условиях
(заражение молекулами РНК из воздуха)Именно такие условия постулировал К. Вуз для возникновения Универсального Предшественника живых существ на Земле [57]: высокий уровень мутаций (ошибок репликации) из-за примитивности и несовершенства механизмов репликации генетического материала, свободный обмен генетическим материалом между предшественниками клеток - "прогенотами" - и коммунальный характер бытия этих предшественников, когда любые продукты и инновации одних становились достоянием всех ("от каждого по способностям - каждому по потребностям"). Однако, в отличие от гипотезы К. Вуза, я бы предпочел отдать роль Универсального Предшественника доклеточной - бесклеточной - форме существования мира РНК, когда еще не было ни ДНК, ни механизмов синтеза белка. Универсальным Предшественником могло быть как раз коммунальное сообщество колоний-ансамблей РНК, существующих и размножающихся на твердых или гелеобразных поверхностях первобытной Земли, не ограниченных физически никакими мембранами и фазовыми разделами и потому свободно обменивающихся как генетическим материалом, так и продуктами катализируемых реакций.
Эта коммунальная форма существования мира РНК - своего рода Солярис, - как уже указывалось, должна была очень быстро эволюционировать. Во всяком случае, весь путь эволюции до индивидуальных организмов с клеточной структурой, ДНК и современным аппаратом белкового синтеза был пройден, по-видимому, менее чем за полмиллиарда лет (период от 4 млрд. до 3.5 млрд. лет назад). Совершенствование колоний-ансамблей РНК за счет естественного отбора должно было происходить в направлении как улучшения каталитических механизмов, так и увеличения точности репликации и наследования. Колонии РНК, "научившиеся" делать белковые катализаторы, естественно, приобретали громадное преимущество перед другими в скоростях и качестве катализируемых реакций и потому быстро вытесняли "неумелых" - как за счет конкуренции, так и за счет передачи им этой способности. На базе РНК появлялся и совершенствовался аппарат белкового синтеза, а ввиду коммунального и пандемического характера мира РНК вырабатывался универсальный генетический код.
Однако кодируемый синтез белков требовал повышенной точности репликации генетического материала и упорядочивания продукции разных белков. Это привело к необходимости дифференциации части РНК (генетической РНК) и ее модификации в ДНК, обладающей способностью к более точному копированию, а к тому же и существенно большей химической стабильностью, чем РНК. Наконец, эффективность и устойчивость таких систем могла быть значительно повышена за счет их обособления от окружающей среды, и они окружаются мембранами белково-липидной природы. Коммунальный мир распадается на индивидуальные, но высоко эффективные ячейки - клетки, особи, организмы, и начинается их собственная эволюция и собственные родословные. Из коммунального Универсального Предшественника выходят две основные ветви микроорганизмов - бактерии (эубактерии) и ар-хеи (архебактерии), формируются их клеточные сообщества на основе взаимодействия их метаболизмов, а затем их симбиотические отношения приводят к появлению химер, и возникают первые эукарии - предшественники высших эукариотических организмов.
Что же стало с миром РНК после распада коммуны? Хотя коммуна распалась, мир РНК сохранился в каждой клетке каждого живого организма. Основой современной жизни является наследуемый биосинтез белков, который определяет все признаки ныне существующих живых организмов. В качестве центрального звена этого процесса биосинтеза белков выступает совокупность взаимодействующих друг с другом молекул РНК различных типов, прежде всего рибосомной РНК, формирующей аппарат белкового синтеза, тРНК, доставляющей в рибосому активированные аминокислоты для построения полипептид-ных цепей белков, и мРНК, несущей в своей нук-леотидной последовательности программу для синтеза белка (см. [13], рис. 1). Кроме этих трех основных представителей внутриклеточного мира РНК, обнаружен целый ряд минорных РНК, обеспечивающих процессы редупликации ДНК и наследования, копирования генов и формирова-
ния мРНК, регуляции синтеза белков, транспорта белков через мембраны, регуляции эмбриогенеза и клеточной дифференцировки, детерминации продолжительности жизни, и так далее. Каждый год открываются все новые виды минорных РНК в клетках современных организмов, выявляется их важнейшая роль в жизни организмов [58].
Еще до недавнего времени мы очень мало знали о внутриклеточном мире РНК, и сейчас происходит серьезная переоценка относительного вклада негенетических РНК в функционирование живых систем. Можно сказать, что совокупность молекул РНК - мир РНК - по-прежнему составляет ядро жизни. Современная жизнь - это РНК. передавшая часть своих генетических функций рожденному ею же родственному полимеру - ДНК, и синтезирующая белки для всеобъемлющего эффективного функционирования содержащих ее компартментов - клеток и многоклеточного организмов.
ЛИТЕРАТУРА
1. Kiesel A., Belozersky A. Uber die Nucleinsaure und die Nucleoproteide der Erbsenkeime // Hoppe-Seyler's Z. physiol. Chemie. 1934. Bd. 229. H. 4-6. S. 160-166.
2. Белозерский A .H., Дубровская И.И. О белках и тимонуклеиновой кислоте семян конского каштана // Биохимия. 1936. Т. 1. С. 665-675.
3. Caspersson Т., Landstrom-Hyden H., Aquilonius L. Cytoplasmanukieotide in eiweissproduzierenden Drusenzellen//Chromosoma. 1941. Bd. 2. S. Ill-131.
4. Bracket J. La detection histochimique et le microdosage des acides pentosenucleiques // Enzymologia. 1941-1942, V. 10. P. 87-96.
5. Avery О .Т., MacLeod CM., McCarty M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types // J. Exp. Med. 1944. V. 78. P. 137-158.
6. Спирин А.С. Современная биология и биологическая безопасность // Вестник РАН. 1997. № 7.
7. Chargaff E. Chemical specificity of nucleic acids and mechanism of their enzymatic degradation // Experientia. 1950. V. 6. P. 201-209.
8. Chargaff E. Structure and function of nucleic acids as cell constituents // Federation Proc. 1951. V. 10. P. 654-659.
9. Wilkins M.F.H., Stokes A.R., Wilson H.R. Molecular structure of deoxypentose nucleic acids // Nature. 1953. V. 171. P. 738-740.
10. Franklin R.E., Gosling R.G. Molecular configuration in sodium thymonucleate // Nature. 1953. V. 171. P. 740-741.
11. Watson J. D., Crick F. H. C. Molecular structure of nucleic acids: A structure for deoxyribose nucleic acid // Nature. 1953. V. 171. P. 737-738.
12. Watson J. D., Crick F. H. C. Genetic implications of the structure of desoxyribose nucleic acid // Nature. 1953. V. 171. P. 964-967.
13. Спирин А.С. Биосинтез белков, мир РНК и происхождение жизни // Вестник РАН. 2001. № 4.
14. Спирин А.С., Белозерский А.Н., Шугаева Н.В., Ванюшин Б.Ф. Изучение видовой специфичности нуклеиновых кислот у бактерий // Биохимия. 1957. Т. 22. С. 744-754.
15. Belozersky A.N., Spirin A.S. A correlation between the compositions of the desoxyribonucleic and ribonucleic acids//Nature. 1958. V. 182. P. 111-112.
16. Crick F.H.C. The present position of the coding problem // Brookhaven Symposia in Biology. 1959. № 12. P. 35-39.
17. Volkin E., Astrachan L. Phosphorus incorporation in Escherichia coli ribonucleic acid after infection with bacteriophage T2 //Virology. 1956. V. 2. P. 149-161.
18. Jacob F., Monod J. Genetic regulatory mechanisms in the synthesis of proteins // J. Mol. Biol. 1961. V. 3. P. 318-356.
19. Спирин А.С., Белицина Н.В., Айтхожин М.А. Информационные РНК в раннем эмбриогенезе // Журнал общей биологии. 1964. Т. 25. С. 321-338.
20. Spirin A.S. Informosomes //European J. Biochem. 1969. V. 10. P. 20-35.
21. Spirin A.S. On "masked" forms of messenger RNA in early embryogenesis and in other differentiating systems // Current Topics in Developmental Biology. 1966. V. 1. P. 1-38.
22. Spirin A.S. Masked and translatable messenger ribonucleoproteins in higher eukaryotes // Translational Control / Eds. Hershey J.W.B., Mathews M.B., Sonenberg N., N.Y.: Cold Spring Harbor Laboratory Press, 1996. P. 319-334.
23. Brenner S., Jacob F., Meselson M. An unstable intermediate carrying information from genes to ribosomes for protein synthesis//Nature. 1961. V. 190. P. 576-581.
24. Gros F., Gilbert W., Hiatt H. et al. Unstable ribonucleic acid revealed by pulse labeling of Escherichia coli // Nature. 1961. V. 190. P. 581-585.
25. Spiegelman S. The relation of informational RNA to DNA // Cold Spring Harbor Symp. Quant. Biol. 1961. V. 26. P. 75-90.
26. Богданова E.G., ГавриловаЛ.П.,Дворкин Г.А., Киселев Н.А., Спирин А.С. Изучение макромолеку-лярной структуры высокополимерной (рибосо-мальной) рибонуклеиновой кислоты из Escherichia coli // Биохимия. 1962. Т. 27. С. 387-402.
27. Spirin A.S. Some aspects of macromolecular structure of high-polymer RNA in solution // Acides ribonucleiques et polyphosphates: Structure, synthese et functions / Eds. Ebel J.P., Grunberg-Manago M. Paris: Editions du CNRS, 1962. P. 73-87.
28. Hall B.D., Doty P. The preparation and physical chemical properties of ribonucleic acid from microsomal particles // J. Mol. Biol. 1959. V. 1. P. 111-126.
29. Спирин А.С., ГавриловаЛ.П., Бреслер С.Е., Мосевицкий М.И. Изучение макромолекулярной структуры инфекционной рибонуклеиновой кислоты из вируса табачной мозаики // Биохимия. 1959. Т. 24. С. 938-947.
30. Spirin A.S. On macromolecular structure of native high-polymer ribonucleic acid in solution // J. Mol. Biol. 1960. V. 2. P. 436-446.
31. Vasiliev V.D., Selivanova O.M., Koteliansky V.E. Specific self-packing of the ribosomal 16S RNA // FEBS Letters. 1978. V. 95. P. 273-276.
32. Vasiliev V.D., Serdyuk I.N., Gudkov А .Т., Spirin A.S. Self-organization of ribosomal RNA // Structure, Function, and Genetics of Ribosomes / Eds. Hardesty B., KramerG. N.Y.: Springer-Verlag, 1986. P. 128-142.
33. Спирин А.С., Киселев Н.А., Шакулов Р.С., Богданов А.А. Изучение структуры рибосом: Обратимое разворачивание рибосомных частиц в рибо-нуклеопротеидные тяжи и модель укладки // Биохимия. 1963. Т. 28. С. 920-930.
34. Lerman M.I., Spirin A.S., Gavrilova L.P., Golov V.F. Studies on the structure of ribosomes: II. Stepwise dissociation of protein from ribosomes by caesium chloride and the re-assembly of ribosome-like particles // J. Mol. Biol. 1966. V. 15. P. 268-281.
35. Gavrilova L.P., lvanov DA., Spirin A.S. Studies on the structure of ribosomes: III. Stepwise unfolding of the 50S particles without loss of ribosomal protein // J. Mol. Biol. 1966. V. 16. P. 473-489.
36. Wimberly B.T., Brodersen D.E., Clemons W.M. et al. Structure of the 30S ribosomal subunit // Nature. 2000. V. 407. P. 327-339.
37. Schlunzen F., Tocilj A., Zarivach R. et al. Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution // Cell. 2000. V. 102. P. 615-623.
38. Ban N., Nissen P., Hansen J. et al. Editions du CNRS, The complete atomic structure of the large ribosomal subunit at 2.4 E resolution // Science. 2000. V. 289. P. 905-920.
39. Yusupov MM., Yusupova G.Zh., Baucom A. et al. Crystal structure of the ribosome at 5.5 A resolution // Science. 2001. V. 292. P. 883-896.
40. Cundliffe E. Involvement of specific portions of ribosomal RNA in defined ribosomal functions: A study utilizing antibiotics // Structure, Function, and Genetics of Ribosomes / Eds. Hardesty B., Kramer G. N.Y.: Springer-Verlag, 1986. P. 586-604.
41. Fourmy D., Recht M.I., Blanchard S.C., Puglisi J.D. Structure of the A site of E. coli 16S rRNA complexed with an aminoglycoside antibiotic // Science. 1996. V. 274. P. 1364-1371.
42. Puglisi J.D., Williamson J.R. RNA interaction with small ligands and peptides // The RNA World, Second Edition / Eds. Gesteland R.F., Cech T.R., Atkins J.F. N.Y.: Cold Spring Harbor Laboratory Press, 1999. P. 403^25.
43. Ellington A., SzostakJ. In vitro selection of RNA molecules that bind specific ligands // Nature. 1990. V. 346. P. 818-822.
44. Tuerk С., Gold L. Systematic evolution of ligands by exponential enrichment // Science. 1990. V. 249. P. 505-510.
45. GoldL., Polisky B., Uhlenbeck 0., Yarus M. Diversity of oligonucleotide functions // Annual Review Biochem. 1995. V. 64. P. 763-797.
46. Kruger К., Grahowski P.J., Zaug A.J. et al. Self-splicing RNA: Autoexcision and autocyclization of the ribosomal RNA intervening sequence of Tetrahyrnena // Cell. 1982. V. 31. P. 147-157.
47. Guerrier-Takada С., Gardiner К., March Т. et al. The RNA moiety of ribonuclease P is the catalytic subunit of the enzyme // Cell. 1983. V. 35. P. 849-857.
48. Cech T.R., Golden B.L. Building a catalytic active site using only RNA // The RNA World. Sec. Ed./Eds. Gesteland R.F., Cech T.R., Atkins J.F. N.Y.: Cold Spring Harbor Laboratory Press, 1999. P. 321-347.
49. Noller H.F., Hoffarth V., Zimniak L. Unusual resistance of peptidyl transferase to protein extraction methods // Science. 1992. V. 256. P. 1416-1419.
50. Nissen P., Hansen J., Ban N. et al. The structural basis of ribosome activity in peptide bond synthesis // Science. 2000. V. 289. P. 920-930.
51. Ahlquist P. RNA-dependent RNA polymerase, viruses, and RNA silencing // Science. 2002. V. 296. P. 1270-1273.
52. Gilbert W. The RNA world // Nature. 1986. V. 319. P. 618.
53. Gilbert W., de Souza SJ. Introns and the RNA world // The RNA World. Sec. Ed./Eds. Gesteland R.F., Cech T.R., Atkins J.F. N.Y.: Cold Spring Harbor Laboratory Press, 1999. P. 221-231.
54. Chetverin A.B., Chetverina H.V., Munishkin A.V. On the nature of spontaneous RNA synthesis by Q{3 replicase // J. Mol. Biol. 1991. V. 222. P. 3-9.
55. Chetverina H.V., Chetverin A.B. Cloning of RNA molecules in vitro // Nucleic Acids Research. 1993. V. 21. P. 2349-2353.
56. Chetverina H.V., Demidenko А.А., Ugarov V.I., Chetverin A.B. Spontaneous rearrangements in RNA sequences // FEBS Letters. 1999. V. 450. P. 89-94.
57. Woese C.R. The universal ancestor // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 6854-6859.
58. Storz G. An expanding universe of non-coding RNAs // Science. 2002. V. 296. P. 1260-1263.