том 71, № 8, с. 725-732, 2001 г.
| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 71, № 8, с. 725-732, 2001 г. |
© В.К. Шумный
ГЕННАЯ И ХРОМОСОМНАЯ ИНЖЕНЕРИЯ
ДЛЯ РАСТЕНИЙВ. К. Шумный
Шумный Владимир Константинович - академик, директор Института цитологии и генетики СО РАН.
Предшественницей биотехнологической революции, основанной на генно-хромосомных манипуляциях у растений, была Зеленая революция. Она завершилась 30 лет назад и принесла впечатляющие результаты: почти вдвое повысилась продуктивность злаковых и бобовых растений, Это было достигнуто благодаря переносу в создаваемые сорта целевых генов, чтобы увеличить прочность стебля путем его укорочения, добиться нейтральности к световому периоду для расширения ареала возделывания и эффективной утилизации минеральных веществ, особенно азотных удобрений. Перенос избранных генов, хотя и в пределах видов, с использованием традиционных методов гибридизации можно рассматривать как прообраз трансгенеза.
Идеолог Зеленой революции Норман Борлуаг, получивший за ее результаты в 1970 г. Нобелевскую премию, предупреждал, что повышение урожайности традиционными методами может обеспечить продовольствием 6-7 млрд. человек. Сохранение демографического роста требует новых технологий в создании высокопродуктивных сортов растений, пород животных и штаммов микроорганизмов. В обращении к форуму по генной инженерии, проходившем в марте 2000 г. в Бангкоке (Таиланд), Борлауг заявил, что "либо уже разработаны, либо мы находимся на завершающих стадиях разработки технологий, которые позволят прокормить население численностью более 10 млрд. человек".
Сопоставление Зеленой революции с происходящей ныне биотехнологической я провел для того, чтобы показать ту социально значимую компоненту, которая лежит в основе всех генно-хромосомных манипуляций. Речь идет о том, как обеспечить население Земли продовольствием, создать более эффективную медицину, оптимальные экологические условия.
Несомненно, что первым импульсом к генной и хромосомной инженерии послужили достижения клеточной биологии, прежде всего реализация методов культивирования клеток, тканей и органов. Для растений главным итогом культу-ральных работ было установление принципа то-типотентности, то есть возможности получения полноценного организма из любой клетки на специальных искусственных средах. Важность этого принципа заключается в том, что любая дифференцированная клетка в специально созданных условиях может повторить весь путь онтогенеза, иными словами, весь путь развития организма. Огромная заслуга в становлении этих работ в нашей стране принадлежит Р.Г. Бутенко из Института физиологии растений РАН [1].
Вторым импульсом для направленного введения чужих генов в геном растений стало открытие механизма встройки почвенной бактерией части своего генома в геном растений. В конце 70-х годов в ряде лабораторий Бельгии, США и ФРГ было показано, что болезнь растений под названием "корончатые галлы" не что иное, как опухолевые образования, которые возникают в результате встройки в геном растения части мегаплазмиды почвенной бактерии Agrobacterium tumefaciens. Это бактерия несет гены, вызывающие опухоли у растений.
Экспериментаторы рассматривают почвенную бактерию как природного геноинженера. Пришлось только обезоружить ее: опухолеиндуцирующую область плазмиды удалили и заменили на искусственно сконструированный вектор, в который включен избранный нами чужой ген, переносимый в ядерный геном растений. Следует отметить, что все трансгенные растения получены нами на основе схемы агробактериального переноса (рис. 1). Однако она эффективна лишь для двудольных растений. Для однодольных, в основном злаковых растений, разработаны другие способы переноса генетических конструкций, из них чаще используется баллистический - с помощью установки под названиями "генная пушка", или "дробовик". На микрочастицы золота или вольфрама помещаются ДНК-векторы и под давлением "выстреливаются" в растительные клетки [2].
| Рис. 1. Схема агробактериального
переноса генов
при получении трансгенных растений. Т-область - часть плазмиды, куда встраивается вектор |
Рис. 2. Технология
получения направленных мутаций у животных
|
|
При любом способе переноса генов необходимо тестирование: встроились ли конструкции в геном и работают ли перенесенные гены. Для этого в любой генетической конструкции есть ген-репортер, который и сообщает, что вектор встроился в геном и работает (экспрессирует). В качестве репортеров используются гены, определяющие устойчивость растительных и животных клеток к антибиотикам. Для растений существенна устойчивость к канамицину, для животных - к неомицину. На среде с антибиотиками клетки, не имеющие в геноме встройки, гибнут, выживают только трансгенные, в геном которых введены чужие гены, в том числе и устойчивости к антибиотикам. Такова в общих чертах кухня получения трансгенных растений, в деталях она гораздо сложнее.
Основным инструментарием для трансгенеза и клонирования животных служат микроинъекции (с помощью микроманипулятора) в совокупности с электропарацией, позволяющие вводить в клетку векторные системы, удалять и вводить ядра и т.д. Одно из самых перспективных направлений в трансгенезе животных - получение нокаутных линий мышей как наиболее удобного лабораторного объекта. У таких мышей "выключены" определенные, заранее избранные гены, что позволяет изучать эффекты их отсутствия и роль в определении признаков. Считается, что это - наиболее адекватные модели для исследования многих патологий, нормальных и отклоняющихся типов поведения, особенно в области нейрофизиологии. Не исключено, что с помощью моделей будут пересмотрены некоторые догмы фармакологии. Появилась перспектива создания адресных фармакологических препаратов, исправляющих дефекты отдельных генов.
На рисунке 2 показана схема создания нокаутных линий мышей, основанная на встройке в избранные гены антисмысловых нуклеотидных последовательностей. Чаще всего разрушают ген. замещая часть его ДНК последовательностью. кодирующей устойчивость к антибиотику неомицину. Далее в процессе гомологичной рекомбинации геномная последовательность, кодирующая интересующий ген, замещается дефектной частью гена. Эта схема получила название технологии индуцирования направленных мутаций.
Однако в проблеме трансгенеза есть ряд нерешенных теоретических проблем, на которых я и сосредоточу свое внимание. Одна из них "сайленсинг" - замолкание встроенных генов. Это явление известно довольно давно, но конкретные механизмы, приводящие к выключению встроенных генов, пока не вполне ясны [3]. В нашей лаборатории создана специальная модель для изучения влияния числа копий генов. За контроль взята встройка одной копии гена глюкуронидазы в связке с геном-репортером по канамицинустойчивости, двух копий генов в прямой последовательности и тех же двух копий, но уже инвертированных друг к другу (рис. 3). Введение повторенных нуклеотидных последовательностей в виде прямых и особенно инвертированных повторов резко снижает уровень экспрессии гена канами-цинустойчивости [4]. Влияние числа копий или места встройки переносимых генов на их экспрессию, уровень активности или полное выключение - лишь один из механизмов явления сайленсинга, активно изучаемого в ряде лабораторий.
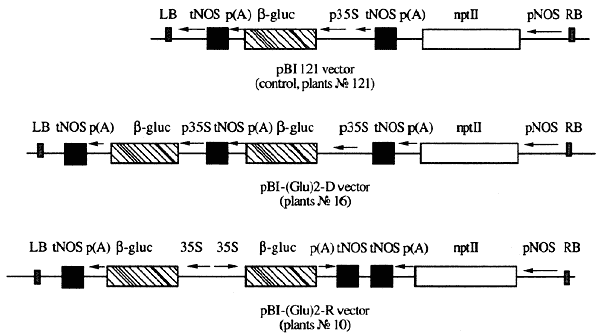
Рис. 3. Схема моделирования нестабильности экспрессии
чужеродных генов в геноме трансгенных растенийДругая важная проблема в процессе трансгенеза - возникновение мутаций как следствие встройки чужеродной ДНК (Т-ДНК инсерций) [5]. Мы изучаем их типы и частоты, собрали целую коллекцию Т-ДНК индуцированных мутаций, характеризующихся измененным строением цветка (табл.) и мужской стерильностью. Мутантные фенотипы появляются с частотой до 5% [6]. Установлено, что у большей части проанализированных растений мутантный фенотип наследуется сцепленно с признаком устойчивости к антибиотику канамицину, что свидетельствует об инсерционной природе мутационных событий в результате интеграции чужеродной ДНК в геном растений.
Получение трансгенных растений ныне превратилось в довольно рутинную технологию для решения практических задач, которыми занимаются как научные учреждения, так и коммерческие фирмы. Мы выбрали для своей прикладной деятельности получение так называемых съедобных вакцин. Этим занимаются многие лаборатории в мире, но пока на экспериментальном уровне. На первых этапах работы мы получили трансгенные растения табака и люцерны с геном Р-интерферона человека, очень мощного иммуногенного фактора. Затем приступили к созданию трансгенных растений табака и люцерны с генами иммуногенных белков микобактерий, вызывающих туберкулез, и с генами оболочки вируса гепатита В. При экспрессии подобных генов в растениях, которые съедают животные, в их организме предполагается получить иммунный ответ с образованием антител на продуцируемый антиген. Иными словами, будет проведена естественная вакцинация по устойчивости к заболеванию туберкулезом или гепатитом В. В этом и заключается смысл создания съедобных вакцин.
Частота встречаемости растений с измененной структурой цветка
Генотип Общее число проанализированных растений Число растений с измененной структурой цветка Нетрансгенные растения
Растения-регенеранты
Трансгенные растения275
240
5800
0
32 (5.5%)В настоящее время у 120 видов растений существуют трансгенные формы. Разрешено использование трансгенных сои, кукурузы, хлопка, рапса, картофеля, томатов, свеклы, тыквы, табака, папай, льна; заканчиваются испытания трансгенного риса и пшеницы. Трансгенные растения выращиваются в 11 странах мира - США, Китае, Аргентине, Канаде, Австралии, Мексике, Испании, Франции, Южной Африке, Португалии и Румынии. В 2000 г. под ними была занята площадь около 40 млн. га.
С использованием трансгенных растений были решены такие проблемы, как гербицидоустойчи-вость, устойчивость к насекомым, к вирусам, к грибковым и бактериальным заболеваниям, регуляция сроков созревания, повышение общей продуктивноети, съедобные вакцины. Сегодня выращивается 71 % трансгенных растений, устойчивых к гербицидам, 22% - к вредителям и 7% - к гербицидам и вредителям (в основном соя, кукуруза, хлопок, рапс). Идет поиск подходов к резкому повышению продуктивности растений.
Считается, что трансгенез у растений и животных - наиболее перспективная биотехнология для решения продовольственной и медицинской проблем на ближайшее десятилетие. Трансгенные животные - козы, овцы, свиньи, коровы - используются для секреции под промоторами "генов молока" высокоактивных биологических веществ для медицины и фармакологии. Уже прошли лицензирование и поступили на рынок полученные через трансгенных животных антитрипсин, применяемый при легочных заболеваниях, антитромбин III для предотвращения инфарктов и инсультов, факторы свертываемости крови, белок С, обладающий защитными функциями, и ряд других.
Во всем мире в средствах массовой информации развернута дискуссия об опасностях применения генетически модифицированных организмов -трансгенных растений и животных. Научной основы для такой обеспокоенности нет, так как наш организм уже давно пользуется продуктами этих генов в виде пула аминокислот и коротких невоспроизводящихся фрагментов нуклеиновых кислот как основы для собственных биосинтетических процессов. Добавлю, что каждое трансгенное растение, рекомендуемое к применению, проходит жесткую проверку по многим параметрам с испытанием на животных и только после этого получает лицензию.
В России также идут бурные дискуссии об опасностях использования трансгенных организмов. Однако в нашей стране пока не возделывается ни одно трансгенное растение, хотя российскими учеными уже созданы трансгенные растения более чем у 20 видов, некоторые из них сейчас проходят тщательную проверку.
Приведу две, до конца еще не решенные проблемы, связанные с использованием трансгенных растений. Первая - утечка трансгенов к другим диким видам-сородичам через спонтанную гибридизацию. Хотя этот процесс маловероятен, он не исключается. Можно представить последствия, когда гены гербицидоустойчивости вдруг окажутся у сорняков. Сегодня многие лаборатории, в том числе и мы совместно с Центром "Биоинженерия" РАН под руководством академика РАСХН К.Г. Скрябина, ведем исследования в этом направлении.
Так как трансгенные растения устойчивы к болезням и вредителям, то не исключается повышение устойчивости самих возбудителей болезней и тех же насекомых-вредителей, то есть их коэволюция. Это вторая проблема, последствия которой необходимо предвидеть. Возможно, что, создавая устойчивость у растений, мы стимулируем процесс отбора более устойчивых возбудителей и вредителей. Естественно, что трансгенез вызывает весьма ощутимые последствия, которые нужно тщательно изучать.
Вторая часть моей статьи посвящена хромосомной инженерии - замещениям хромосом на внутривидовом, межвидовом и межродовом уровнях. Несмотря на заманчивые перспективы трансгенеза, манипуляции на хромосомном уровне не менее важны потому, что мы имеем дело с растительными, "родными генами", и можем переносить их естественным путем через гибридизацию крупными скоординированно работающими блоками. Наибольшие успехи сегодня достигнуты в замещении отдельных хромосом на внутривидовом уровне у злаковых, в первую очередь у пшеницы.
Летом 2000 г. в Институте цитологии и генетики состоялся Международный симпозиум по анеуплоидии у растений, на котором были подведены итоги по созданию полных замещенных серий у пшеницы. Таких серий в мире уже известно около 30. Одной из лучших признана созданная в нашем институте серия по комбинации Саратовская 29 х Янецкис Пробат. Это означает, что у сорта Саратовская 29 каждая из 21 пары хромосом замещена на гомологичную хромосому от сорта-донора Янецкис Пробат. В нашей серии доказано, что чистое замещение прошло по 18 и 21 хромосомы (так в тексте - V.V.). По трем хромосомам продолжается проверка. Чтобы понять смысл этой работы, покажем, к чему привело замещение двух хромосом сорта Диамант на гомологичные хромосомы сорта Новосибирская 67. У сорта Диамант высокий процент клейковины, но плохие хлебопекарные качества, у сорта Новосибирская 67 - наоборот. Две хромосомы с генами высокого качества были перенесены в сорт Диамант. Заменив две гомологичные хромосомы, мы получили высокое хлебопекарное качество, сохранив высокое содержание клейковины. Эта технология открывает новые возможности в селекции, когда нужно подправить отдельные признаки, а не реконструировать весь организм, комбинируя в процессе гибридизации тысячи генов.
Но в ряде случаев, когда исчерпана внутривидовая изменчивость, уже не удается усилить до необходимого уровня селекционируемые признаки, прежде всего устойчивость к заболеваниям и вредителям, солеустойчивость, морозостойкость. Тогда приходится заимствовать необходимые гены у других видов, родов растений, в том числе и у диких сородичей. Однако для этого необходимо знать, существуют ли у этих видов искомые гены и в каких хромосомах они локализованы. Перенос генов, замещение соответствующих хромосом осуществляется через гибридизацию, иногда с использованием методов культивирования клеток, тканей, зародышей.
В Институте цитологии и генетики СО РАН проводятся межвидовые, межродовые замещения хромосом. Придание мягкой гексаплоидной пшенице Triticum aestivum устойчивости к различным видам ржавчины, мучнистой росе и другим видам заболеваний оказалось возможным при замещении двух пар ее хромосом 5В и 6В на хромосомы от третраплоидной пшеницы Triticum timopheevii. Этот вид был найден еще в 30-е годы Н.И. Вавиловым с сотрудниками в одном из районов Грузии и оказался мощным источником генов устойчивости к заболеваниям у пшеницы. Если листья мягкой пшеницы поражены ржавчиной, то у сорта донора и полученных на его основе замещенных по двум хромосомам форм листья остаются зелеными и нормально функционируют в процессе фотосинтеза [8].
По другим признакам, таким как солеустойчивость, содержание белка в зерне, уже необходимо прибегать к межродовым замещениям хромосом у пшеницы, то есть заимствовать гены у более отдаленных сородичей. В нашем институте проведена работа по пшенично-ржаному замещению [9]. Одна из хромосом пшеницы 1А замещалась на хромосому ржи IR, что позволило повысить у замещенной линии пшеницы солеустойчивость (рис. 4). Замещение 2А хромосомы пшеницы на 2R хромосому ржи привело к получению форм пшеницы с более высоким содержанием белка в зерне.
В нашей лаборатории осуществлен болишой цикл исследований по межродовой гибридизации ячменя и пшеницы, ячменя и ржи. При этом в качестве материнской формы использовались как культурные, так и дикие виды ячменя [10, 11]. Естественно, что для получения гибридов таких отдаленных родов, не скрещивающихся в природе, пришлось изолировать зародыши и культивировать их на искусственных средах. Выращенные растения проводились через культуру клеток, из которых регенерировались полноценные растения.
Рис. 4. Уровень солеустойчивости проростков сорта Cap 29 и пшенично-ржаной замещенной линии IR (1А) к NaCI (концентрация раствора 1.26%) Анализ полученных гибридов, их скрещивание с исходными формами позволили создать серии замещенных и дополнительных линий пшеницы. В первом случае речь идет о замещении целых хромосом пшеницы на хромосомы ячменя, во втором случае, как правило, - об отдельных вставках хромосомных фрагментов ячменя в хромосомы пшеницы, что является результатом рекомбинаци-онного процесса, происходящего в мейозе. Флюо-ресцентная in situ гибридизация позволяет покрасить хромосомы пшеницы и ячменя в разные цвета, и тогда под световым микроскопом можно зафиксировать весь процесс обмена хромосомным материалом, проследить за изменением структуры хромосом в ходе гибридизации.
Следующий шаг в хромосомной инженерии растений - получение аллоплазматических линий, что означает сочетание ядра одного вида или рода растений с цитоплазмой другого. Речь идет уже о замещении не отдельных хромосом, а целых геномов. Используя явление элиминации у гибридов геномом одного вида (рода) растений генома другого, удалось создать ячменно-пшеничные формы, у которых присутствуют ядерный геном пшеницы, цитоплазма и элементы цитоплазматического генома ячменя [12]. Эти аллоплазматические линии по своему фенотипу больше повторяют пшеницу, но у них проявлялись отдельные признаки ячменя, например, раннеспелость и устойчивость к ряду заболеваний. Естественно, что полученные формы уже используются в селекционных программах ряда стран. В то же время аллоплазматические линии представляют собой универсальную модель для изучения ядерно-плазменных взаимодействий, роли ядра и цитоплазмы в проявлении признаков.
Более подробно остановлюсь на работе сотрудника нашего института В.А. Бердникова, так как считаю, что она открывает новые возможности для преобразования генома растений [13]. В обычный диплоидный геном гороха была введена дополнительная хромосома и получена трисомная линия. Дополнительная хромосома состоит из коротких плеч двух пар диплоидного набора хромосом гороха. На первом этапе создания трисомной линии гороха обнаружена полная рекомбинационная изоляция экстрахромосомы, то есть отсутствие ее конъюгации, а следовательно, и обмена хромосомным материалом с другими хромосомами. В митозе и мейозе экстрахромосома ведет себя как унивалент.
Вторым этапом работы было маркирование экстрахромосомы (рис. 5), чтобы трисомные растения можно было отбирать по фенотипу. Так как дополнительная хромосома состояла из плеч 3 и 6 хромосом, в хромосому 3 диплоидного набора была введена рацессивная мутация, вызывающая абберантные листья, а в экстрахромосому -аллель дикого типа этой мутации. В результате этого генетического эксперимента все обычные диплоидные растения имели абберантные листья, а трисомные растения - нормальные листья, что позволило их легко отличать друг от друга уже на стадии проростков.
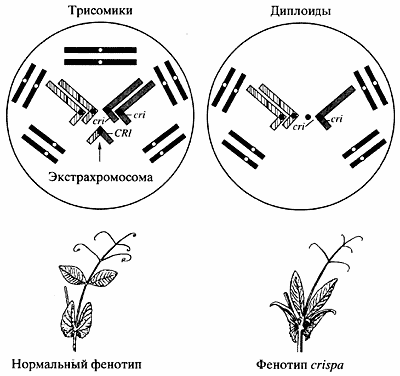
Рис. 5. Потомки трисомной линии гороха TRIS с нормальными и измененными листьями
(cri - ген формы листьев)Однако остается еще одна проблема. Так как дополнительная хромосома в мейозе ведет себя как унивалент, доля трисомиков в линиях колебалась от 25 до 50%. Для того чтобы получать линии со 100%-ным выходом трисомиков, то есть имеющих в своем кариотипе 15 вместо 14 хромосом, понадобился еще один генетический прием. В коротком плече хромосомы 3 обычного диплоидного набора была индуцирована летальная мутация, приводящая к гибели растений. Только у эктрахромосомы остался нормальный аллель этой мутации, обеспечивающий нормальное развитие растений. В результате все диплоидные 14-хромосомные растения погибали и сохранялись только трисомные, имеющие 15 хромосом. Таким образом была получена линия со 100%-ным выходом трисомиков гороха, в кариотипе которых 15 хромосом вместо 14.
Эта изящная в цитогенетическом плане работа завершает логическую цепочку всех хромосомных манипуляций на растениях - от хромосомных замещений на всех уровнях до создания новых хромосом. Совершенно очевидно, что это - новый и очень мощный инструмент для хромосомной инженерии. Дополнительная хромосома может быть использована для насыщения ее необходимыми полезными генами и как вектор для введения в геном новых генов.
Сегодня ясно, что эволюция генома от низших организмов до высших в значительной части шла путем сохранения блоков генов, определяющих основные метаболические процессы. В ходе эволюции блоки генов усложнялись регуляторными системами, уровнями активности, новыми функциями, уровнями взаимодействия генов между собой. Учитывая эти обстоятельства, в нашем институте несколько лет назад начали разрабатывать теорию генных сетей, положив в ее основу принцип: реализация каждого признака - результат действия не отдельных генов, а скоординированно работающих комплексов генов, функционально, иногда и структурно связанных между собой. Уже создано около 30 моделей таких генных сетей [14].
На рисунке 6 показан фрагмент генной сети по такому сложному признаку, как симбиотическая азотфиксация у бобовых растений. Геномы бактерии ризобиум и самого растения, взаимодействуя, образуют на корнях клубеньки-фабрики, где и происходит обмен между партнерами метаболитами, восстановление ферментом нитрогеназа N2 до NH3 и определяется дальнейший процесс фиксации азота. В этом процессе задействовано множество скоординированно работающих генов как в геноме бактерии, так и в геноме растения. Среди них есть ключевые и вспомогательные; между ними существуют сложные иерархические взаимоотношения.
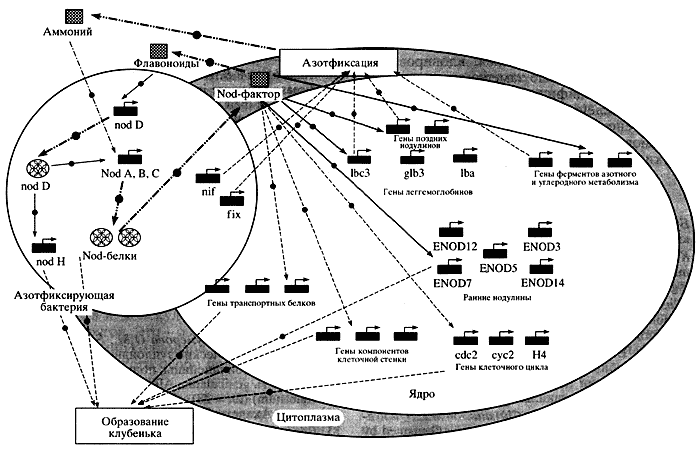
Рис. 6. Фрагмент генной сети, демонстрирующий образование
азотфиксирующих клубеньков у бобовых растенийЕсли мы в будущем собираемся кардинально реконструировать геномы, хотя бы методами трансгенеза и хромосомных замещений, то нужно стремиться к переносу не отдельных генов и хромосом, а блоков, скоординированно работающих на признак генов, - ключевых элементов генных сетей. Поэтому так важно накопление знаний о функциях известных генов, их локализации. Идеальный вариант - если бы гены, определяющие основные параметры признаков, были локализованы сцепленными блоками, что значительно облегчило бы их перенос.
Еще одна актуальная проблема - векторы для введения в геном блоков генов. Нельзя исключать, что такими векторами могут служить дополнительные хромосомы.
Итак, в биотехнологии растений решены проблемы культивирования клеток, тканей и органов, регенерация растений, трансгенез, замещение хромосом на разных систематических уровнях, введение дополнительных хромосом, составленных из частей уже функционирующих. На очереди создание новых векторных систем, формирование генных сетей, поиск сцепленных и скоординированно работающих блоков генов. По этой же логической цепи развиваются исследования и на животных - культивирование клеток, тканей, клонирование, трансгенез, хромосомные замещения, - хотя здесь имеются свои специфические проблемы и трудности. Перечисленное, естественно, не исчерпывает всех генетических подходов к реконструкции геномов высших организмов в необходимом для науки и практики направлении.
ЛИТЕРАТУРА
1. Бутенко Р.Г. Тотипотентность растительной клетки и культура тканей. М.: Наука, 1970.
2. Klein Т.М., Wolf E.D., Wu R., Sandorf J.C. High velosity microprojectiles for delivering nucleic acids into living // Nature. 1987. P. 327.
3. Matske M.A., Prirnig M., Tronovsky J. Reversible methylation and inactivation of marker genes in sequentially transformed tobacco plants // EMBO J. 1989. V. 8.
4. Дейнеко Е.В., Загорская А.А., Филипенко Е.А. и др. Нестабильность экспрессии гена nptll у трансгенных растений табака (Nicotiana tabacum L.) при инбридинге // Генетика. 1998. № 9.
5. Feldmann K.A., Marks D.A., Christianson M.L., Quatrano R.S. A Dwarf Mutant of Arabidopsis Generated by T-DNA Insertion Mutagenesis // Science. 1989. V. 243.
6. Дейнеко Е.В., Загорская А.А., Сидорчук Ю.В. и др. Особенности морфологических признаков и фертильности пыльцы у трансгенных растений табака // Физиология растений. 2000. № 1.
7. Maistrenko O.I., Pshenichnikova T.A., Popova O.M. The development of I A, 6D doube substitution line Diamant I / Novosibirskaya 67: the final stade // EWAC Newsletter. 1998.
8. Budashkina Е.В., Kalinina N.P. The transfer of genes for disease resistanse in cultivated plants: gemiplasm as a method of their preservation and creation of biodiversity. (The example of obtaining the introgressive lines in common wheat) // Biodiversity and Dynamics of Ecosystems in North Eurasia. 2000. V. 1. Part 3.
9. Щапова А.И., Силкова О.Т., Кравцова Л.А. Роль генов эквационного деления унивалентов в межгеномном замещении хромосом // Генетика. 1997. № 4.
10. Шумный В.К. Проблема генетики растений // Генетика. 1997. № 8.
11. Шумный В .К., ПершинаЛ.А., Нумерова Н.П. и др. Аллоплазматические замещенные линии мягкой пшеницы, полученные на основе ячменно-пшеничных гибридов Н. vulgare L. (2п = 14) х Т. aestivum L. (In = 42) // Доклады Академии наук. 1995. Т. 340. № 6.
12. Першина Л.А., Нумерова O.M., Белова Л.И. и др. Аллоплазматические эуплоидные и анеуплоидные линии мягкой пшеницы, полученные на основе гибридов Н. geniculatum All. (= Н. marinum subssp. gussoneanum) (In = 28) x T. aestivum L. (2n = 42) // Доклады Академии наук. 1998. Т. 360. № 1.
13. Berdnikov V.A., Corel F.L., Kosterin O.E. New mutations in the linkage group U have provided stable trisomic lines of pea // Pisum Genetics. 2000. V. 32.
14. Колчанов НА., Ананько Е.А., Колмаков Ф.А. и др. Генные сети // Молекулярная биология. 2000 Т. 34. № 4.
Сентябрь 2001