| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 70, № 4, с. 299-306 (2000) |
| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 70, № 4, с. 299-306 (2000) |
© С.Г. Инге-Вечтомов
ПРИОНЫ ДРОЖЖЕЙ
И
ЦЕНТРАЛЬНАЯ ДОГМА МОЛЕКУЛЯРНОЙ БИОЛОГИИС. Г. Инге-Вечтомов
Инге-Вечтомов Сергей Георгиевич - член-корреспондент РАН,
заведующий кафедрой генетики и селекции ЛГУ.
Данное исследование было поддержано РФФИ (грант № 99-04-4960)Современный взгляд на генетическую информацию запечатлен в таблице генетического кода [1]. В ней 61 из 64 возможных сочетаний по три основания рибонуклеиновой кислоты соответствуют 20 аминокислотам, из которых построены белки. Три оставшихся сочетания (UAA, UAG, UGA) представляют собой своего рода стоп-сигналы, или сигналы прекращения роста молекулы белка. Этот код квазиуниверсален, то есть справедлив (с небольшими модификациями) для всех живых существ [2].
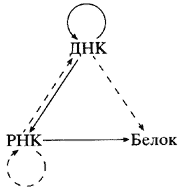
Рис. 1. Пути переноса генетической информации (центральная догма молекулярной биологии)
Сплошные стрелки - универсальный путь переноса генетической информации; штриховые - пути, наблюдаемые в некоторых специальных случаях
Пути переноса генетической информации в клетке обобщает предложенная Ф. Криком так называемая центральная догма молекулярной биологии (рис. 1) [3]. Основной путь переноса: от генов - дезоксирибонуклеиновой кислоты (ДНК), способной к самовоспроизведению, - к рибонуклеиновой кислоте (РНК), иногда способной к самовоспроизведению, и, наконец, - к белкам. На этом этапе заканчивается путь переноса информации. Она не возвращается к нуклеиновым кислотам, а белки не способны к самовоспроизведению. До последнего времени считалось аксиомой, что чередование аминокислотных остатков в полипептидных цепях, то есть первичная структура белков, однозначно определяет характер их складывания и тем самым функциональную активность [4, 5]. Эти представления были поколеблены в значительной степени благодаря исследованиям, о которых пойдет речь дальше.
Центральная догма - своеобразное современное воплощение закона А. Вейсмана о ненаследовании модификаций, то есть изменений признаков, приобретаемых в онтогенезе.
ПРИОНЫ НАРУШАЮТ ЦЕНТРАЛЬНУЮ ДОГМУ?
На фоне этих представлений вполне еретически прозвучало открытие инфекционных белков-прионов, являющихся переносчиками ряда нейродегенеративных заболеваний человека и животных [6]. Основной вклад в концепцию инфекционных белков-прионов связывают с именем С. Прусинера, удостоенного за это Нобелевской премии в 1997 г. [7].
Из всех этих неизлечимых смертельных заболеваний человека и животных наиболее известно в последнее время так называемое коровье бешенство, оно же - губчатая болезнь мозга коров, или BSE (Bovine SponGIForm Encephalopathy).
Куру - первое, наиболее подробно исследованное в конце 50-х годов Д.К. Гайдушеком заболевание этого типа у человека, распространившееся среди членов племени Форе (Новая Гвинея) в результате ритуального каннибализма.
Кроме того, существуют еще три синдрома: болезнь Кройцфельда-Якоба, болезнь Герштона-Штресслера-Шейнкера и смертельная семейная бессонница.
РгРC РгРSc
Аналогичные болезни известны у целого ряда млекопитающих, прежде всего у овец и коз (а также у мышей, хомяков, кошек и др.) под названием скрэпи, или почесуха. Возбудителем всех этих заболеваний является инфекционный белок-прион, обозначаемый как РгРSc (от Scrapi). Этот белок имеет нормальный клеточный гомолог, то есть неболезнетворный и неинфекционный белок, обозначаемый как РгРC (от Cellular, то есть клеточный) [8]. Слово прион возникло как модифицированное сокращение английского: Protenacious Infection - белковая инфекция.
Особую "популярность" эти заболевания приобрели в связи с данными об инфекционности коровьего бешенства для человека. В последние годы идентифицирована новая разновидность болезни Кройцфельда-Якоба у человека, идентичная по некоторым молекулярным характеристикам BSE [9, 10]. Это имеет печальный эпидемиологический аспект, а также акцентирует возможность межвидового переноса прионной инфекции, что в общем-то было известно уже с начала 80-х годов из экспериментов с животными, прежде всего с мышками и хомячками, если не считать, что еще раньше Гайдушек показал заразность куру для обезьян [6, 11].
Характерным проявлением всех этих заболеваний на последних стадиях их развития служит образование в тканях головного и спинного мозга миелоидных тяжей и бляшек, состоящих из упомянутого прионного белка РгРSc. При этом ткани мозга на срезе приобретают вид губки. Отсюда и наименование "губчатая болезнь мозга".
Любая из перечисленных болезней может иметь три варианта возникновения:
а) инфекционный (уже упомянутый),б) наследственный,
в) спорадический, то есть появление, казалось бы, без видимых причин, когда не просматривается ни наследственной предрасположенности, ни инфекции.
МОЛЕКУЛЯРНАЯ ГЕНЕТИКА ПРИОНОВ МЛЕКОПИТАЮЩИХИнфекционное начало оказалось ассоциированным именно с упомянутыми белковыми образованиями головного или спинного мозга. При этом белок-прион (РгРSc) из этих высокомолекулярных агрегатов и растворимый неинфекционный белок (РгРC) здоровых особей имеют одинаковую первичную структуру, то есть одинаковую аминокислотную последовательность, но различаются по вторичной и третичной структуре, то есть характером укладки полипептидной цепи (рис. 2).

Рис. 2. Предполагаемое изменение характера укладки полипептидной цепи
при превращении белка РгРC (а) в прион РгРSc (б)В белке РгРSc обнаруживается существенно больше так называемых b-слоев - около 43% (в РгРC -3%)-и несколько уменьшается количество (43-34%) так называемых a-спиралей. При этом инфекционный белок, образующий уже упомянутые амилоидные тяжи, оказывается более кислотоустойчивым, термоустойчивым и более устойчивым к протеолизу, нежели его клеточный гомолог РгРC. Оказалось, что инфекционный белок возникает путем модификации своей структуры из обычного клеточного белка и при этом приобретает свойство инфекционности [8].
На короткий период конца 70-х - начала 80-х годов возникла гипотеза белковой наследственности, то есть наследственности без ДНК, коль скоро инфекционный агент - белок, а он к тому же еще и накапливается в зараженном организме, то есть воспроизводится. Эта сенсация просуществовала недолго, так как вскоре был открыт ген, который кодирует первичную структуру, то есть аминокислотную последовательность белка-приона и его клеточного предшественника. Ген оказался очень консервативным, то есть очень похожим у всех млекопитающих [12]. Функция его до сих пор точно неизвестна. Зато известно, что он необходим для развития заболевания. Мыши, лишенные этого гена, вполне жизнеспособны и практически здоровы [13], но не заболевают, если их инфицировать белком-прионом [14].
На рис. 3 показана структура этого гена (PRNP) человека. Сверху - известные варианты нормального полиморфизма, то есть аминокислотные замены, не приводящие к заболеванию. Внизу - мутационные замены, приводящие к нейродегенеративным заболеваниям [8]. Особый интерес представляет начальный конец гена и соответственно так называемый N-терминальный конец белка. Здесь закодированы пять повторов из восьми аминокислот.
Уменьшение числа повторов на один не сопровождается патологическими последствиями, в то время как увеличение числа повторов (известны варианты вплоть до 12 повторов) приводит к одной из наследственных форм заболевания [8]. Следовательно, эти повторы играют существенную роль в организации структуры белка и каким-то образом влияют на возможность его превращения в инфекционную форму.
Итак, наследственные варианты заболевания - результат мутационного изменения первичной структуры белка, облегчающего превращение его в прион и далее - превращение всех вновь синтезируемых полипептидов в прионную, патогенную и инфекционную форму.
Спорадическая форма заболевания - спонтанное изменение характера укладки полипептидной цепи, превращающее клеточный белок в прион, а далее - опять же превращение всех вновь синтезируемых полипептидов в прионную, то есть инфекционную и патогенную, форму. Здесь очень важно отметить, что при одной и той же первичной структуре, то есть одной и той же аминокислотной последовательности, без всяких изменений кодирующего гена может возникнуть несколько вариантов укладки приона, и эти различающиеся варианты укладки воспроизводятся при последующей инфекции. Они получили название штаммов или правильнее - клонов приона [15].
И, наконец, инфекционная форма прионных заболеваний - результат проникновения в организм, в клетку млекопитающих инфекционного белка, возникшего любым из двух упомянутых способов.
В стандартные концепции легко укладывается возникновение наследственных форм заболевания. Можно представить, что одна первичная структура служит основой для разных способов пространственной укладки белковой молекулы. Чего мы не понимаем - как одна форма укладки сменяет другую и как далее эта укладка воспроизводится. То, что это явление (воспроизведение пространственной структуры, или конформации) имеет место, доказывают изящные эксперименты с так называемыми трансгенными мышами, у которых собственный ген PRNP заменен на гомологичный ген человека (рис. 4).
Можно взять прион от людей, погибших от разных вариантов прионных заболеваний. Такие белки различаются по физико-химическим свойствам, выявляемым в электрофорезе, то есть по подвижности в электрическом поле после их частичного разрушения при помощи протеолиза [16, 17]. Если этими различающимися формами белка человека заразить такую мышь, то она рано или поздно заболеет (инкубационный период - около 150 дней) и можно выделить белок-прион с исходными характеристиками инфекционного начала [18]. Таким образом, в результате модификации пространственной структуры белка могут появляться штаммы, или клоны, прионов. Механизм этого явления остается загадкой.
ОБЩАЯ БИОЛОГИЯ ПРИОНОВ
В последние годы, начиная с 1993 г., вся эта экзотика, касавшаяся определенной категории заболеваний у млекопитающих, приобрела общебиологическое значение. Аналогичные явления были расшифрованы у грибов, в первую очередь у дрожжей. Эти исследования составляют предмет отечественного приоритета. Они выполнены в трех коллективах: на кафедре генетики Ленинградского, ныне Санкт-Петербургского, государственного университета, в Кардиологическом центре Минздрава в Москве в лаборатории профессора М.Д. Тер-Аванесяна и в Институте молекулярной биологии РАН им. В.А. Энгельгардта в лаборатории члена-корреспондента РАН Л.Л. Киселева в кооперации с некоторыми зарубежными коллегами.
Проведенные исследования представляют собой прекрасную иллюстрацию ревнивого высказывания Ч. Вайсмана, одного из классиков прионологии: "Явления, открытые у высших эукариот (к которым относятся и млекопитающие. - С. И.-В.), приобретают дополнительную респектабельность, если они также обнаруживаются у дрожжей" [19]. Как мы увидим, речь пойдет не только об иллюстративности.
У дрожжей нет ни мозгов, ни нервов, и потому по определению речь не может идти о нейродеге-неративных заболеваниях этих объектов. Тем не менее есть белки, характер изменчивости и наследование которых доказывают существование прионов и у дрожжей.
Что это за белки? Чтобы ответить на этот вопрос, вернемся к таблице генетического кода. 61 кодон, или триплет, этой таблицы узнают специальные транспортные РНК (тРНК), и только три оставшихся кодона - знаки терминации, или стоп-сигналы, узнают специальные белки. Это было известно у бактерий, а в последние годы сходные белки обнаружены и у эукариот млекопитающих, лягушек и дрожжей. Гены, кодирующие эти белки, мы изучаем у дрожжей с середины 60-х годов [20], а в 1970 г. нами было высказано предположение, что эти гены дрожжей (SUP35 и SUP45) кодируют именно белки, вовлеченные в процесс терминации трансляции [21]. Позже эта гипотеза получила подтверждение в прямых биохимических исследованиях Л.Л. Киселева и других, идентифицировавших продукты генов SUP45 и SUP35 как факторы терминации трансляции eRF1 и eRF3 соответственно [22, 23]. В начале 90-х годов нам удалось выяснить в совместных исследованиях, прежде всего с группой М.Д. Тер-Аванесяна, что один из этих генов, а именно ген SUP35, кодирует дрожжевой прион.
РАСШИФРОВКА СИСТЕМЫ SUP35-[PSI]
В любом гене стоп-сигнал может появиться не на своем месте в результате мутации. Тогда синтез соответствующего белка будет блокирован, поскольку произойдет преждевременная терминация синтеза этого белка. Если же инактивировать упомянутый уже белок-фактор терминации, узнающий стоп-сигналы, они же нонсенсы, то эти сигналы будут читаться как значащие и синтез соответствующего белка будет восстановлен. Это явление называется нонсенс-супрессией. Отсюда и название гена SUP от английского suppression. Тогда, имея нонсенс-кодоны не на своем месте в каких-либо генах, мы легко можем видеть, работает ли этот самый белок-фактор терминации. Есть супрессия - не работает. Нет супрессии - работает.
Оказалось, что фактор терминации можно инактивировать двумя способами: мутационным путем, и тогда соответствующий нонсенс-супрессор наследуется, согласно менделевской схеме, как ядерный ген [21].
Тот же белок может быть инактивирован за счет его модификации без изменения гена. Тогда нонсенс-супрессор передается с цитоплазмой и не обнаруживает менделевского расщепления. Собственно, такой цитоплазматический супрессор был известен давно, его открыл британец Б. Кокс в 1965 г. и назвал [PSI]-фактором [24]. С тех пор никому не удавалось объяснить физическую природу его наследования.
Наш результат заключался в том, что мы сумели показать: усиление экспрессии нормального немутантного гена SUP35, кодирующего фактор терминации, приводит с большой частотой к возникновению этого самого цитоплазматически наследуемого нонсенс-супрессора, или [РSI]-фактора [25,26]. Появление в клетке большого числа молекул фактора терминации при сверхэкспрессии гена SUP35 увеличивает вероятность, в пересчете на клетку, его перехода в иную, полностью или частично неактивную конформацию. Возникает нонсенс-супрессия. Очевидно сходство с прионами млекопитающих.
Именно эти результаты и использовал Р. Уикнер, когда произнес словосочетание "прионы дрожжей" [27]. Белковая природа дрожжевого приона - [РSI]-фактора - была доказана тем, что необходима именно активная "наработка" белка, кодируемого геном SUP35, а не увеличение копийности этого гена или количества соответствующей информационной РНК [26].
Инфекционен ли дрожжевой прион? Инфекционность PSI-фактора можно показать, передавая при гибридизации только цитоплазму дрожжей, но не передавая ядро, в котором локализован ген SUP35. При этом вместе с цитоплазмой передается и свойство нонсенс-супрессии.
СХОДСТВО ПРИОНОВ МЛЕКОПИТАЮЩИХ И ДРОЖЖЕЙ
Особенностью и преимуществом дрожжевой модели является возможность изгнать прион, "вылечить" клетки, действуя на них небольшими концентрациями (5 мМ) гидрохлорида гуанидина [29]. При этом мы убедились в том, что затем в таких излеченных клетках могут вновь появиться [PSI]-прионы, различающиеся так же, как различаются клоны (они же штаммы) приона млекопитающих. Эти факты были одними из первых аргументов в пользу наличия в геноме дрожжей структурного гена, кодирующего загадочный в то время [PSI]-фактор [30].
Особое внимание следует уделить чертам сходства структуры этих двух в целом разных белков - РгР млекопитающих и фактора терминации eRF3 дрожжей. В обоих случаях в начальной N-терминальной части полипептида (рис. 5) есть характерные аминокислотные повторы, обогащенные глицином (G), глутамином (Q) и ароматическими аминокислотами (W, Y) [8, 31]. Такие структуры склонны к образованию b-слоев, которыми и обогащены белки-прионы в отличие от своих клеточных предшественников. Этот участок дрожжевого белка оказался принципиально важным для прионизации, то есть превращения фактора терминации в [PSI] - дрожжевой прион. Если этот участок убрать, делегировать из хромосомы соответствующий участок гена, не удастся ни индуцировать прион, ни "размножать его", если он уже есть в клетке. Тогда он просто теряется [32]. Увы, нельзя убрать весь ген. Ген SUP35, кодирующий фактор терминации синтеза белка у дрожжей, незаменим. В этом отличие прионной системы человека от такой же системы млекопитающих.
Рис. 5. Сравнение аминотерминальных участков в белке-прионе человека (РгР Homo sapiens) и белке-факторе терминации трансляции eRF3, кодируемом геном SUP35 дрожжей (Sup35p Saccharomyces cerevisiae) Выделены повторяющиеся аминокислотные последовательности. Цифры - положения аминокислотных остатков
Значение концевых повторов в индукции и "размножении" дрожжевых прионов подчеркивает и тот факт, что для индукции [PSI]-фактора достаточно в клетке сверхэкспрессировать не весь ген, а только ту его часть, которая кодирует эти повторы [26].РАЗМНОЖЕНИЕ ПРИОНА
Область исследования дрожжевых прионов очень быстро стала модной на Западе. В течение весны и лета 1997 г. в двух американских лабораториях были получены сенсационные результаты. Было показано, что дрожжевые прионы в клетках образуют такие же белковые агрегаты, как и прионы млекопитающих в тканях мозга [33]. Более того, удалось показать, что образование дрожжевого приона может происходить вне клетки - в бесклеточном растворе [34]. Причем для этого достаточно только фрагмента белка, содержащего прионизирующие повторы [35].
Самые интересные результаты по эффективному размножению приона в бесклеточной системе получила группа М.Д. Тер-Аванесяна. Если в экстракт из клеток, не содержащих [РSI]-фактор, добавить очень небольшое количество экстракта из клеток, содержащих этот дрожжевой прион, то количество белка-приона быстро нарастает. Теперь в качестве затравки можно взять немного материала из этой смеси и вновь добавить его в экстракт из клеток без [PSI]-фактора. Результат будет тем же самым. И это можно повторять бесконечно [36].
ГИПОТЕЗА КОНФОРМАЦИОННЫХ МАТРИЦ
Открытым остается вопрос о механизмах возникновения нового характера укладки (конформации) белка приона и последующего воспроизведения этой конформации. Очевидно, что спонтанно возникший или привнесенный в клетку прион далее превращает все вновь синтезируемые полипептиды с идентичной или очень близкой ему первичной структурой в свое подобие [6]. Напрашивается гипотеза о существовании своеобразного механизма копирования конформации, или гипотеза конформационных матриц.
В пользу этого предположения говорит результат, недавно полученный в нашей лаборатории. Если в дрожжевую клетку, не содержащую [PSI]-фактор, но потенциально способную его поддерживать, ввести искусственно сконструированный ген, кодирующий прионизующий пептид, - те аминокислотные повторы, которые содержит фактор терминации с пришитым к нему геном ADE-2, кодирующим один из ферментов синтеза пуринов [37], то в клетке появляется дрожжевой прион - [РSI]-фактор. Такая реакция является следствием введения в клетку дополнительной копии прионизующего пептида. О прионизации фактора терминации eRF3 мы судим по появлению нонсенс-супрессии. Этот прион можно изгнать при помощи гидрохлорида гуанидина, как и обычный дрожжевой прион. Интересно, однако, что такой прион можно изгнать и другим способом - просто потеряв из клетки введенный ранее искусственный ген. Следовательно, возникший или индуцированный в клетке дрожжевой прион требует для своего последующего размножения именно тот же белок, который его индуцировал.
Дело в том, что если вы индуцируете прион, используя дополнительные копии непосредственно гена SUP35, кодирующего фактор терминации, способный прионизироваться и превращаться в [PSI]-фактор, то потеря этой дополнительной копии гена, или прекращение его сверхэкспрессии, не приведет к потере [PSI] [25], ибо такой же ген останется в хромосоме и материал, необходимый для воспроизведения прионной конформации, будет синтезироваться в клетке. Искусственно индуцированный [PSI]-фактор "помнит" индуцировавший его белок и требует его присутствия для дальнейшего "размножения". Налицо характеристика матричного процесса, но при этом воспроизводятся не сами молекулы белка, а только их конформация.
Таким образом, в клетке, видимо, существуют две категории матричных процессов: копирование последовательностей ДНК и РНК (см. рис. 1) и копирование конформации, характерное по крайней мере для некоторых белков. Своего рода матричное воспроизведение конформации имеет место в таких процессах, как образование структур цитоскелета при росте актиновых и тубулиновых волокон, воспроизведение ядерной мембраны, копирование внешнего кортекса у простейших. Эти механизмы могут лежать в основе так называемой эпигенетической наследственности/изменчивости.
Вряд ли можно считать случайным совпадением то, что исследуемые нами факторы терминации синтеза белка имеют непосредственное отношение к функциям цитоскелета. Дело в том, что мутации по гену SUP35, кодирующему фактор терминации, приводят не только к нонсенс-супрессии. Они делают клетки сверхчувствительными к беномилу - агенту, специфически разрушающему микротрубочки, входящие в состав цитоскелета и образующие нити, ответственные за правильное расхождение хромосом [38]. Видимо, поэтому упомянутые мутанты проявляют повышенную нестабильность хромосом в митозе. К аналогичному эффекту в мейозе приводит инактивация гомолога SUP35 у мухи Drosophila melanogaster [39].
На основании этих данных можно предположить, что дрожжевой прион - своеобразный побочный результат процесса обычного конформационного копирования элементов цитоскелета в клетке.
Результаты данного исследования показывают, что феномен прионов не является экзотикой, характерной для млекопитающих, а скорее - частным случаем общебиологического механизма, лежащего в основе эпигенетического наследования. На это же указывает изучение другого приона дрожжей - фактора [URE3], вовлеченного в регуляцию метаболизма азота. Он был открыт в 1971 г. Ф. Лакрутом [40]. Известен также прион het-s, контролирующий тип несовместимости у гриба Podospora anseria, открытый недавно в лаборатории Бежере [41].
В результате представленной здесь работы создана модельная система для изучения у дрожжей механизма возникновения и поисков лечения прионных заболеваний человека и животных. Преимущества данной модели очевидны. Дрожжи - прекрасно разработанный молекулярно-генетический объект. Известна полная последовательность ДНК его генома. Он дешевле мышей, у него больше разрешающая способность генетического анализа, а кроме того, эти исследования свободны от морально-этических проблем, связанных с правами человека и животных. Дрожжевые прионы, в отличие от прионов млекопитающих, не представляют опасности для человека.
Если теперь вернуться к началу нашего рассказа - к центральной догме молекулярной биологии (см. рис. 1), то ее следует дополнить. Необходимо ввести в нее возможность модифицирования и копирования конформации белков.
ЛИТЕРАТУРА
1. Crick F.H.C. The genetic code - yesterday, today, and tomorrow // Cold Spring Harbor Symp. Quant. Biol. 1966. V. 31. P. 3-9.
2. Osava S., Jukes Т.Н., Watanabe K., Muto A. Recent evidence for evolution of the genetic code // Microbiol. Rev. 1992. V. 56. P. 229-264.
3. Айала Ф., Кайгер Дж. Современная генетика. Т. 2. М.: Мир, 1988. С. 34-66.
4. Sanger F. The structure of insulin // Currents in Biochemical Research. Wiley Interscience. N.Y., 1956.
5. Сенгер Ф. Лауреаты Нобелевской премии. Т. 2. М.: Прогресс, 1992. С. 379-383.
6. Aguzzi A., Weissmann С. Prion research: the next frontiers //Nature. 1997. V. 389. P. 795-798.
7. Prusiner S.B. Prions // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 13363-13383.
8. Prusiner S.B. Molecular biology and pathogenesis of prion diseases //TIBS. 1996. 21 December. P. 482-487.
9. Collinge J., Sidle K.C.L., Meads J., Ironside J., Hill A.F. Molecular analysis of prion strain variation and the aetiology of "new variant" CJD // Nature. 1996. V. 383. P. 685-690.
10. Almond J., Pattison J. Human BSE // Nature. 1997. V. 389. P. 437-438.
11. Prusiner S.B., Scott M.R., DeArmond S.J., Cohen F.E. Prion protein biology // Cell. 1998. V. 93. P. 337-348.
12. Gabriel J.-M., Oesch B., Kretzschmar H., Scott M., Prusiner S.B. Molecular cloning of a candidate chicken prion protein //Proc. Natl. Acad. Sci. USA. 1992. V. 89. P. 9097-9101.
13. Bueler H., Fischer M., Lang Y., Bluetmann H., Lipp H.-P., DeArmond S.J., Prusiner S.B., Aguet M., Weissmann C. Normal development and behaviour of mice lacking the neuronal cell-surface PrP protein // Nature. 1992. V. 356. P. 577-582.
14. Sailer A., Bueler H., Fischer M., Aguzzi A., Weissmann C. No propagation of prions in mice devoted of PrP // Cell. 1994. V. 77. P. 967-968.
15. Bessen R.A., Marsh R.F. Distinct PrP proteins suggest the molecular basis of strain variation in transmissible mink encephalopathy //J. Virol. 1994. V. 68. P. 7859-7868.
16. Aguzzi A., Weissmann C. A suspicious signature // Nature. 1996. V. 383. P. 666-667.
17. Parchi P., Capellari S., Chen S.G., Petersen R.B., Gambetti P., Kopp N., Brown P., Kitamoto Т., Tateishi J., Giese A., Kretzschmar H. (with reply by: Collinge J., Hill A.F., Sidle K.C.L., Ironside J.). Typing prion iso-forms // Nature. 1997. V. 386. P. 233-234.
18. Prusiner S.B., Scott M.R. Genetics of prions // Ann. Rev. Genet. 1997. V. 31. P. 139-175.
19. Weissmann C. The Prion Connection: Now in Yeast? // Science. 1994. V. 264. P. 528-530.
20. Инге-Вечтомов С.Г. Реверсии к прототрофности у дрожжей, нуждающихся в аденине // Вестник Лен. университета. Сер. 3, Биол. 1964. № 2. С. 112-116.
21. Инге-Вечтомов С.Г., Андрианова В.М. Рецессивные суперсупрессоры у дрожжей // Генетика. 1970. Т. 6. С. 103-116.
22. Frolova L., Le Goff X., Rasmussen H., Cheperegin C., Drugeon G., Kress M., Arman I., Haenni A .-L., Celis J., Philippe M., Justesen J., Kisselev L. A highly conserved eukaryotic protein family possessing properties of polypeptide chain release factor // Nature. 1994. V. 372. P. 701-703.
23. Zhouravleva G., Frolova L., Le Goff X., Le Guillec R., Inge-Vechtornov S.G., Kisselev L., Philippe M. Termination of translation in eukaryotes is governed by two interacting polypeptide chain release factors eRF1 and eRF3 // EMBO J. 1995. V. 14. P. 4065^072.
24. Сох B.S. Y, a cytoplasmic suppressor of super-suppression in yeast // Heredity. 1965. V. 20. P. 505-521.
25. Chernoff Yu.O., Derkach I.L., Inge-Vechtornov S.G. Multicopy SUP35 gene induces de novo appearance of psi-like factors in the yeast Saccharomyces cerevisiae // Curr. Genet. 1993. V. 24. P. 268-270.
26. Derkatch I.L., Chernoff Y.O., Kushnirov V.V., Inge-Vechtornov S.G., Liebrnan S.W. Genesis and variability of [PSI] prion factors in Saccharomyces cerevisiae // Genetics. 1996. V. 144. P. 1375-1386.
27. Wickner R.B. [URE3] as an altered URE2 protein: evidence for a prion analog in Saccharomyces cerevisiae // Science. 1994. V. 264. P. 566-569.
28. Chernoff Yu.O., Lindquist S.L., Ono B., Inge-Vechtomov S.G., Liebrnan S.W. Role of the chaperone protein Hsp104 in propagation of the yeast prion-like factor [PSI+] // Science. 1995. V. 268. P. 880-884.
29. Tuite M.F., Mundy C.R., Cox B.S. Agents that cause a high frequency of genetic change from [psi+] to [psi-] in Saccharomyces cerevisiae // Genetics. 1981. V. 98. P. 691-711.
30. Тиходеев О.Н., Гетманова Е.В., Тихомирова B.Л., Инге-Вечтомов С.Г. Неоднозначность трансляции у дрожжей: генетический контроль и модификации // Молекулярные механизмы генетических процессов. Сборник. M.: Наука. 1990. С. 218-228.
31. Kushnirov V.V., Ter-Avanesyan M.D., Telckov M.D., Surguchov A.P., Smirnov V.N.. Inge-Vechtornov S.G. Nucleotide sequence of the SUP2 (SUP35) gene of Saccharomyces cerevisiae // Gene. 1988. V. 66. P. 45-54.
32. Ter-Avanesyan M.D., Kushnirov V.V., DagkesamanskayaA.R., Didichenko SA., Chernoff Yu.O.,lnge-Vechtomov S.G., Smirnov V.N. Deletion analysis of the SUP35 gene of the yeast Saccharomyces cerevisiae reveals two nonoverlapping functional regions in the encoded protein // Molec. Microbiol. 1993. V. 7. P. 683-692.
33. Lindquist S. Mad cows meet Psi-chotic yeast: The expansion of the prion hypothesis // Cell. 1997. V. 89. p. 495-498.
34. Glover J.R., Kowal A.S., Schirmer E.G., Patino M.M., Liu J.J., Lindquist S. Self-seeded fibers formed by Sup35, the protein determinant of [PSI+], a heritable prion-like factor of S. cerevisiae // Cell. 1997. V. 89. P. 811-819.
35. King C.-Y., Tittman P., Gross H., Geber R., Aebi M., Wuthrich K. Prion-inducing domain 2-114 of yeast Sup35 protein transforms in vitro into amyloid-like filaments // Proc. Natl. Acad. Sci. USA. 1997. V. 94. P. 6618-6622.
36. Paushkin S. V., Kushnirov V.V., Smirnov V.N., Ter-Avanesyan M.D. In vitro propagation of the prion-like state of yeast Sup35 protein // Science. 1997. V. 277. P. 381-383.
37. Inge-Vechtornov S.G., Sasnauskas K., Alenin V.V., Borchsenius A.S., Zadorsky S.P., Forafonov F.S. Fusion of N-terminal part of Sup35p with Ade2p and the problem of artificial yeast prion. Abstracts of "The Sixteenth International Symposium on the Life Sciences [1997]. Molecular Recognition in Biological Systems" at Kyoto Research Park. Kyoto, Japan. 1997. P. 30-33.
38. Tikchomirova V.L., Inge-Vechtornov S.G. Sensitivity of sup35 & sup45 mutants in Saccharomyces cerevisiae to anti-microtubule drug benomyl // Curr. Genet. 1996. V. 30. P. 44^9.
39. Basu J., Williams B.C., Lee Z.X., Williams E.V., Goldberg M.L. Depletion of a Drosophila homolog of yeast Sup35p disrupts spindle assembly, chromosome segregation and cytokinesis during male meiosis // Cell Motility and the Cytoskeleton. 1998. V. 39. P. 286-302.
40. Lacrout F. Non-Mendelian mutation allowing ureido-succinic acid uptake in yeast // J. Bacteriol. 1971. V. 106. P. 519-522.
41. Coustou V., Deleu C., Saupe S., Begueret J. The protein product of the het-s heterokaryon incompatibility gene of the fungus Podospora anserina behaves as a prion analog // Proc. Natl. Acad. Sci. USA. 1997. V. 94. P. 9773-9778.
Май 2000