Юбилейный номер - журналу 15 лет
ПРОБЛЕМЫ ТЕРАПИИ
С ИСПОЛЬЗОВАНИЕМ
СТВОЛОВЫХ КЛЕТОК
|
Юбилейный номер - журналу 15 лет |
ЭТИЧЕСКИЕ И ЮРИДИЧЕСКИЕ
ПРОБЛЕМЫ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ СТВОЛОВЫХ КЛЕТОК |
© Ю.М. Лопухин, С.А. Гусев
СТВОЛОВЫЕ КЛЕТКИ:
НАУЧНЫЕ ВОЗМОЖНОСТИ,
МОРАЛЬНЫЕ БАРЬЕРЫЮ.М. Лопухин, С.А. Гусев
Лопухин Юрий Михайлович - академик РАМН,
директор НИИ физико-химической медицины Минздрава РФ,
председатель Комитета по биоэтике при президиуме РАН.Гусев Сергей Андреевич - доктор медицинских наук, профессор,
заведующий лабораторией морфологии НИИ ФХМ МЗ РФ.В обычной клинической практике этические коллизии возникают и решаются, как правило, между двумя участниками - пациентом и врачом. В случае применения стволовых клеток (СК) к ним прибавляется третья сторона - донор этих клеток. Проблемы получения, культивирования и трансплантации СК составляют самостоятельный пул сложных этических вопросов.
Большинство известных способов извлечения стволовых клеток сопровождаются деструктивными действиями: разрушением оплодотворенной яйцеклетки или эмбриона на ранней стадии развития, искусственным прерыванием беременности и т.д. Во многих странах, особенно католического мира, такие вмешательства приравниваются к антигуманным действиям, к акту убийства, и считаются категорически недопустимыми. В этих странах, как, впрочем, и во многих других с иной религиозной ориентацией эмбрионы любой стадии развития потенциально считаются человеческим существом *.
* Биомедицинская этика. М., 1997,1999, 2002; Лопухин Ю.М. Биоэтика. Избранные статьи и доклады (1993-2003). М., 2003.Ту же позицию отстаивают известные международные документы, в частности "Всеобщая декларация прав человека" (1948) и "Международная конвенция гражданских и политических прав" (1966). В американской конвенции по правам человека (1969, п. 4) говорится: "Каждый человек имеет право на уважение своей жизни. Это право должно быть защищено законом на протяжении всей жизни от момента зарождения". "Европейская конвенция по защите прав и достоинств человека" 1997 года запрещает создание эмбрионов в исследовательских целях.Между тем, значение и цена проблемы стволовых клеток чрезвычайно велики. Ежегодно миллионы людей страдают и умирают от дегенеративных инкурабельных заболеваний головного мозга, сердца, печени, почек, поджелудочной железы, сетчатки глаза, мышечной дистрофии и др., в лечении которых могут помочь стволовые клетки.
Основные дегенеративные заболевания человека
Болезни ЦНС Болезнь Паркинсона, болезнь Альцгеймера, рассеянный склероз, посттравматические заболевания,
инсульты, травматические заболевания спинного мозгаБолезни сердца Инфаркт миокарда, постинфарктные осложнения, врожденные пороки сердца Внутренние болезни Диабет (первого и второго типа), хронический панкреатит Болезни костей и суставов Остеоартрит, остеопороз Болезни крови и иммунитета Иммунодефициты, лейкемии, врожденные болезни крови Болезни печени Гепатиты, циррозы Травматические болезни Ожоги Болезни глаз Макулярная дистрофия, атрофия сетчатки Болезни мышечной системы Мышечная дистрофия, ДЦП Первый президент Национального консультативного этического комитета Франции Жан Бернар (Comite Consultatif National d'Ethique), реконструируя историю биомедицины с 1930 года, писал о двух революциях: терапевтической и биологической *. Первая революция, открыв сульфамиды (1937) и пенициллин (1946), наделила человечество "властью побеждать болезни, долгое время бывшие смертельными, такие как туберкулез, сифилис, серьезные заражения крови, воспаления эндокринных желез, биохимические расстройства, лежащие в основе душевных заболеваний".
* Sgrecca Е., Tambone V. Bioethicca. 2001.Вторая революция произошла совсем недавно: она началась с открытия генетического кода и создания так называемой "геномной медицины". После успеха Яна Вилмута, клонировавшего в 1997 году живое существо - овцу Долли *, и работ Томпсона **, в 1998 году доказавшего возможность получения стволовых клеток из бластоцист *** с последующим культивированием плюрипотентных клеточных линий **** у человечества наконец появилась реальная надежда на излечение различных дегенеративных заболеваний (см. таблицу) или, как минимум, уменьшение страданий пациентов путем трансплантации стволовых клеток.* Velmut I., Schnicka A.E. at al. Viable offspring derived from fetal and adult mammalian cells // Nature. 1997. V. 385. P. 810-813.В апреле 2003 года в Брюсселе, под эгидой Европейского союза, прошла одна из наиболее представительных конференций с участием более 600 ученых, посвященная итогам и перспективам развития проблемы стволовых клеток и терапевтического клонирования *. Конференция отметила, что за последние годы число частных и государственных компаний, занимающихся этой проблемой, сократилось с 38 до "менее дюжины". Это объясняется несколькими причинами. Не оправдались коммерческие планы компаний, потребность в стволовых клетках оказалась крайне низкой, что обусловлено, главным образом, неопределенными и неубедительными результатами клинических наблюдений. Во многих случаях, по мнению экспертов, не публикуются отрицательные результаты пересадок CК.** Thomson J.A., Itskovitz-Eldor J. at al. Embryonic stem cell lines derived from human blastocysts // Science. 1998. №282. P. 1145-1147.
*** Бластоциста - ранний эмбрион, состоящий из 30-150 клеток на 4-7 день развития. Содержит клеточную массу, которая служит основным источником эмбриональных стволовых клеток.
**** Плюри (мульти) потентность - способность стволовой клетки дифференцироваться в несколько типов клеток различных органов.
* Commission of the European Communities. Report on Human Embryonic Stem Cell Research. Brussels. 2003. № 3,4.Определилась настоятельная необходимость в дополнительных теоретических и экспериментальных исследованиях с использованием современных методов маркировки и идентификации стволовых клеток, включая анализ их генов и белков. Примерно к таким же выводам пришла и конференция по стволовым клеткам, проведенная в сентябре 2003 года в нашей стране по инициативе комиссии РАМН, возглавляемой академиком РАМН В.Н. Ярыгиным.
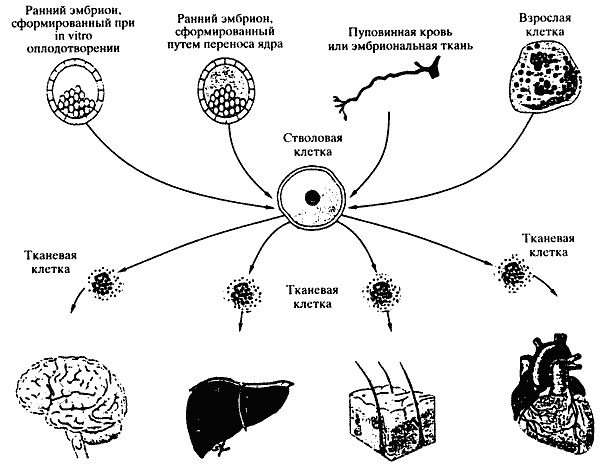
Получение и дифференцировка стволовых клеток
В настоящее время известно несколько источников получения стволовых клеток: костный мозг, пуповинная кровь, кожа, гонады (см. рисунок). Большое внимание уделяется так называемым лишним бластоцистам, по тем или иным причинам невостребованным, но приготовленным для целей экстракорпорального оплодотворения (ЭКО). При использовании таких бластоцист выдвигается ряд обязательных этических правил. В принципе они несложны и вполне приемлемы. Прежде всего, необходимо свободное информированное согласие матери или обоих супругов на использование лишнего бластоциста. Требуется также официальное одобрение и утверждение исследовательского протокола национальным или ведомственным этическим комитетом или административным органом.
В международных документах особо подчеркивается необходимость полностью исключить продажу или покупку зародыша, что на самом деле очень важно во избежание эксплуатации женщины, унижения ее достоинства, обмана путем псевдодиагностики и т.п. Требуется также сохранять анонимность генетических родителей стволовых клеток: данные о них не должны знать ни донор, ни реципиент. Важна доступность результатов исследования, открытая и полная публикация полученных данных. Стволовые клетки из "лишних" эмбрионов чужеродны по отношению к неродственному реципиенту, что в конечном счете делает вполне вероятной их гибель, хотя современная иммуносупрессорная терапия может продлить их жизнь на неопределенно долгий срок. Пока неясной остается проблема изменения свойств эмбриональных стволовых клеток при их длительном культивировании.
Но главное в другом.
В нашей стране, например, в соответствии с международными нормами и приказом МЗ РФ (№ 301 от 28.12.1993 года) "лишние" бластоцисты должны сохраняться некоторое время в замороженном виде, но затем непременно уничтожаться. Лишь в шести странах приняты законы, разрешающие их использование в исследовательских целях: США, Великобритания, Финляндия, Греция, Голландия и Швеция. В пяти странах полностью запрещено использование бластоцист: в Австрии, Дании, Франции, Ирландии и Испании. В большинстве других европейских стран, в частности в Италии и Португалии, а также в России, по этому вопросу нет законодательств. В Германии разрешен ввоз эмбриональных стволовых клеток.
Особое значение как в научном, так и в практическом плане отводится стволовым клеткам, полученным по классической методике Я. Вилмута. Методика предусматривает перенос ядра соматической клетки одного индивидуума в лишенную ядра яйцеклетку (ооцит) другого, с последующим выращиваем зиготы в искусственной среде до стадии бластоцисты, содержащей полипотентные стволовые клетки. Эти клетки генетически тождественны донору ядра соматической клетки и поэтому аутологичны по отношению к нему.
Описанная методика практически лишена каких-либо серьезных этических ограничений, кроме опасности тайного применения полученных бластоцист для клонирования целого существа, что запрещено во всех странах мира и отнесено к категории тяжких преступлений. Яйцеклетку, как показывают эксперименты на животных, можно извлечь из яичника свежего трупа, что избавит от необходимости получения информированного согласия от донора яйцеклетки. Возникает необходимость в разработке достоверных тестов на жизнеспособность трупного ооцита и наличия в его цитоплазме необходимых для развития эмбриона факторов роста.
Такой способ получения линии аутологичных эмбриональных стволовых клеток, разумеется, особенно в первое время, окажется дорогим и доступным только для лечения отдельных пациентов. Вместе с тем, он может рассматриваться в качестве идеальной модели для изучения механизма репрограммирования генома соматической клетки в цитоплазме ооцита. В конечном счете репрограммирование соматических клеток может стать идеальным решением всей проблемы получения аутологичных полипотентных клеток и реальным путем лечения дегенеративных заболеваний армии безнадежных больных. Это, несомненно, будет величайшим научным событием XXI века - века генетики.
Что касается других источников стволовых клеток, следует обратить внимание на такие моменты. При использовании плодов, особенно при поздних абортах, для получения эмбриональных стволовых или прогениторных * клеток следует получить информированное согласие женщины на использование абортивного материала и одобрение программы исследования комитетом по биоэтике. Этическими правилами особо подчеркивается необходимость не допускать коммерциализации таких исследований. Это необходимо прежде всего для того, чтобы избежать психологического давления на мать (с помощью денежного подкупа или путем ложной оценки состояния ее плода) при получении ее согласия на прерывание беременности.
* Первичные прогениторные клетки - стволовые клетки половых зачатков эмбриона.Получение стволовых клеток из таких источников, как пуповинная кровь, кожа или костный мозг, не нуждается в каких-либо особых этических ограничениях. Европейский Союз в 2003 году определил пять принципов, которым необходимо следовать при испытании стволовых клеток в клинике:1. Уважение достоинства человека.Кроме того, обязательно соблюдение трех правил:2. Индивидуальная автономия (информированное согласие, уважение частной жизни, конфиденциальность персональных данных).
3. Справедливость и польза (в частности, улучшение и защита здоровья).
4. Свобода исследований (в согласии с другими фундаментальными принципами).
5. Пропорциональность (т.е. применение минимального набора методов исследования, необходимых для достижения цели).
• свободное информированное согласие пациента:Решающее значение имеет правильная оценка соотношения риска и пользы. Необходимо тестирование клеточного материала на вирусы, бактерии и токсины, особенно важное при трансплантации генетически модифицированных клеток. Этические комитеты не должны также преувеличивать пользу от трансплантации стволовых клеток. Что касается защиты здоровья пациентов, вовлеченных в клинические исследования, то здесь в первую очередь нужно свести к минимуму необратимые и потенциально опасные последствия. Там, где это возможно, следует предусмотреть меры для устранения или обратного развития нежелательных осложнений.• объективная оценка соотношения риск/польза;
• защита здоровья пациента, вовлеченного в клинические исследования.
Если сравнивать ситуацию в нашей стране и на Западе, то надо сказать, что у нас такой анализ сделать практически невозможно. Существуют лишь единичные наблюдения, многие исследования проводятся скрытно и основаны на коммерции, широко используется так называемая фетальная терапия, очень высока активность некоторых хирургов. Например, на Западе, включая Кубу, Мексику и США, за десять лет, было сделано 200 трансплантаций специальных дофаминергических клеток для лечения болезни Паркинсона без каких-либо удовлетворительных результатов. В нашей же стране только за последние три года проведено 20 операций. Создается впечатление легкого отношения хирургов к пересадкам мозговой ткани - без серьезного, глубокого анализа и обсуждения результатов.
В заключение необходимо подчеркнуть, что следует совершенствовать законодательную базу применения СК, прежде всего в части использования "лишних" бластоцист при ЭКО. Необходимо разрешить опыты по терапевтическому клонированию, главным образом для изучения механизма репрограммирования генома соматической клетки.
Особую тревогу вызывает коммерциализация клеточной терапии, которая, как нетрудно понять, толкает некоторых исследователей на необоснованные операции, на создание дорогих клеточных препаратов. При этом грубо нарушаются общепринятые этические нормы.
Этический комитет Российской академии медицинских наук, включающий выдающихся ученых страны, готов регулярно и внимательно рассматривать проекты каждого исследования, посвященного стволовым клеткам, привлекая, если будет необходимо, к рецензированию независимых специалистов других ведомств и даже стран с последующей передачей соответствующих документов в комиссию при МЗ РФ для окончательного решения.
© Л.Н. Скуратовская, М. Робра, B.C. Репин
НОВОЕ ЗНАНИЕ - НОВЫЕ ОПАСНОСТИ
Л.Н. Скуратовская, М. Робра, B.C. Репин
Скуратовская Лариса Николаевна - кандидат медицинских наук,
ученый секретарь Института общей патологии и патофизиологии РАМН.Робра Мартин - руководитель отдела Всемирного совета церквей, Женева.
Репин Вадим Сергеевич - член-корр. РАМН, профессор,
научный консультант фирмы РеМеТекс.Статья подготовлена по материалам доклада авторов на конференции
"Genetic engineering and medical ethics. New knowledge - new challenges".
24-30 April. 2004. Bossey, WCC, Geneva.Последние 20 лет в биологии отмечены важными открытиями и методическими прорывами, которые приблизили клеточную биологию и эмбриологию к миру научной фантастики. От трансплантации ядер и репрограммирования генома - к клонированию, от эмбриональной стволовой клетки - к лабораторному получению ранних зародышей и органогенезу in vitro, от ДНК-чипов - к компьютерным чипам головного мозга, от силиконовых киборгов - к организмам-химерам, собранным из клеток разных видов *.
* Репин B.C., Ржанинова А.А., Шаменков Д.А. Эмбриональные стволовые клетки: фундаментальная биология и медицина. М., 2002; Репин B.C. Где кончается смерть и начинается жизнь // НГ-Наука. 28 января 2004; Gepstein L. Derivation and potential Application of Human Embryonic Stem Cells // Cirec. Res. 2002. №91. P. 866-876.Уникальные свойства эмбриональных стволовых клеток (ЭСК), их практически неограниченная способность к пролиферации (размножению) и дифференцировке (специализации) в любой тип соматических клеток взрослых органов в лабораторных условиях сделали эти замечательные творения природы объектом номер один для научных и прикладных исследований *. Естественные клеточные границы и барьеры, ранее привычно маркировавшие границы индивидуума и вида, стали "размываться" с помощью трансплантации ЭСК и их производных. Можно, по-видимому, даже говорить о том, что клеточные территории организмов стали более пластичными и динамичными, если иметь в виду возможности встраивания и длительного выживания донорских клеток в тканях реципиента **.* Репин B.C., Ржанинова А.А., Шаменков Д.А. Указ.соч.Этот начавшийся передел границ и маркеров территории индивидуальной жизни поднимает новые вопросы, многие из которых не имеют однозначных ответов и заставляют переосмысливать ценности человеческой жизни не только в сфере медицины. Показательно быстро растут дискуссии вокруг науки и бизнеса стволовых клеток. Цель данной статьи - дать читателю представление о существующих и нерешенных проблемах в этой области, которые являются сейчас предметом многопланового анализа.** Outka G. The Ethic of Human Stem Cells Research // Kennedy Inst. of Ethics J. 2002. № 12. P. 175-213.
Плюрипотентные стволовые клетки человека: краткая история вопроса
Самые первые стволовые клетки человека были получены из бластоцисты - зародыша на стадии 250-350 клеток. Эта стадия развития, как в организме матери, так и в культуре достигается на 5-й день после оплодотворения яйцеклетки. Эмбриональные стволовые клетки в культуре пролиферируют достаточно интенсивно, но линии, которые можно достаточно долго культивировать в лабораторных условиях, удается выделить лишь из 1-2% исходных клеток зародыша. Многие даже считают ЭСК лабораторным феноменом, поскольку в ранних зародышах эти клетки не идентифицируются. Тем не менее, благодаря неограниченной пролиферации в культуре и способности к вторичной дифференцировке в любую клетку разных органов (плюрипотентности), ЭСК представляют собой уникальный биоресурс каждого человека и всего человечества.
Однако проекты с ЭСК человека идут с большими препятствиями. Главное затруднение связано с источниками клеток. Первые 30 линий ЭСК человека были получены из резервных бластоцист, оставшихся после операции искусственного оплодотворения. Многие страны наложили вето на лабораторное изготовление бластоцист для получения ЭСК. Сохраняется мораторий на все пути лабораторного создания суррогатной яйцеклетки (переносом ядра соматической клетки в денуклеированную яйцеклетку реципиента, путем слияния соматической клетки с цитоплазмой яйцеклетки, партеногенезом и т.д.).
Лабораторное создание ранних зародышей человека не является этически обоснованной процедурой еще и потому, что юридический и биоэтический статус индивидуальной жизни между стадиями одной клетки и 250 клеток пока четко не прописан. Если лабораторные эмбрионы получат юридический статус новой жизни, эксперименты с такими структурами станут окончательно невозможными - эквивалентными опытам на людях.
Один из морально допустимых путей решения проблемы - получение ЭСК из ранней неорганизованной зародышевой ткани, в "обход" морфогенеза раннего зародыша (лабораторной эктодермы или мезодермы).
Другое важное препятствие для клинического использования ЭСК - ранняя презентация клетками главных антигенов гистосовместимости. В организме реципиента такие клетки неизбежно уничтожаются его иммунной системой. Локальный позитивный эффект от введения ЭСК в организм связан со стимуляцией регенерации, а не с истинной заместительной клеточной терапией.
Долгое время считалось, что во взрослом организме плюрипотентные стволовые клетки (ПСК) отсутствуют, поскольку их существование ограничено периодом эмбрионального развития. Однако в 70-е годы XX века были опубликованы работы, продемонстрировавшие наличие ПСК практически во всех органах взрослых животных и человека *. Теперь принято разделять стволовые клетки на ЭСК и ПСК. Последние чаще всего выделяют из жировой или мышечной тканей, или эпидермиса и дермы кожи. ПСК - важный резерв организма. Разработка методов перевода ПСК в культуру, без потери их плюрипотентности в ходе клеточных делений, а также способов длительного их хранения создали новую базу для индивидуализированной клеточной терапии.
* Н.Е. Young. Existence of reserve quiescent stem sells in Adults Curr. Topics Microbiol. // Immunol. 2002, V.914, P. 212-214.Резервные ПСК -будущее клеточной биологии и медицины
Все подтипы взрослых ПСК характеризуются следующими признаками. Они длительно пролиферируют в культуре, не теряя исходного незрелого фенотипа. После остановки пролиферации и добавления специальных "сигналов" они направленно дифференцируются в специализированные клетки взрослых органов. При трансплантации ПСК в головной мозг, мышцу, печень и т.д. они обязательно, под влиянием факторов микроокружения, дифференцируются в преобладающий в органе тип соматических клеток. В культуре геном этих клеток обладает удивительной пластичностью, т.е. способностью перепрограммироваться в разные фенотипы. Существенно, что эти клетки перепрограммируются и в ЭСК. Наконец, найден путь получения ЭСК в культуре в обход оплодотворения и создания лабораторных бластоцист. Изолированные ПСК можно длительно размножать и банкировать на будущее.
Новый смысл приобретают экспериментальные попытки перепрограммирования взрослых резервных ПСК в лабораторный дубликат зиготы, поскольку геном этих клеток наделен не только плюрипотентностью, но и способностью к так называемому up-stream репрограммированию, т.е. они могут возвращаться к более раннему эмбриональному статусу.
Поскольку ПСК изначально являются частью взрослого организма, биоэтика не возражает против их использования в клинике для заместительной клеточной терапии. Однако репрограммирование этих клеток до суррогатных лабораторных зигот дает "зеленый свет" созданию техногенных зародышей из генома уже существовавшего человека. В ближайшее время ожидается получение лабораторных дублеров стволовых клеток, которые, по-видимому, смогут повторять ранние стадии эмбриогенеза человека in vitro. Каждый этап развития зародыша будет задублирован лабораторными стволовыми клетками. Онтогенез человека станет полностью повторяющимся клеточным циклом. Необратимые химические или физические поломки ДНК, старение молекул и мембран смогут устраняться постоянной сменой старых клеток на новые.
Какими мерками и критериями следует оценивать возвращение "на круги своя" клеток уже живущего генома? Доступность стволовых клеток индивидуального организма фундаментально меняет наши представления о необратимости онтогенеза. Ведь соматический эмбриогенез широко распространен в мире растений и низших животных.
ЭСК и ПСК -ключевые клетки для репрограммирования генома индивидуума
Стволовые клетки взрослых тканей - сегодня единственный морально допустимый клеточный материал для изучения индивидуального генома человека, законов его реализации и повторения. ПСК, подобно розеттскому камню, кодируют законы индивидуальной жизни на языках ДНК, РНК, белков, межклеточных коммуникаций и эмбриогенеза, а также на языке периодического обновления клеток в постнатальных органах. Они, как компактные диски, хранят программы управления активностью 5000 генов эмбриогенеза, которые стали теперь доступны экспериментаторам in vitro.
Уникальность взрослых ПСК в том, что они позволяют в реальном времени декодировать как универсальные, общевидовые программы, так и индивидуальные программы развития одного организма.
Незаменимость же их в том, что они позволяют исследователям продвигаться вверх от "текста" гена к его функции: сперва в одном типе клеток, затем в разных органах и, наконец, в целом организме.
ПСК в одном лице - и "программисты" (софт-мейкеры) и "операторы" программ эмбриогенеза. Новые и новые подпрограммы развития последовательно реализуются новыми генерациями клеток зародыша. "Провизорные" клетки зародыша, исполнившие свою роль, удаляются из организма. Освободившееся пространство немедленно занимают новые клетки, которые реализуют новые программы развития.
В отличие от обычных соматических клеток, зародыш собирается и организованно растет из повторяющихся модулей, границы которых очерчены информационными программами развития. СК, в отличие от соматических клеток взрослого организма, способны вне зародыша создавать такие многоклеточные модули, которые по частям воспроизводят внутриутробное развитие человека или млекопитающих. Уникальная способность этих клеток воспроизводить эмбриогенез человека в лабораторных условиях делает их ключевыми игроками современной биологии.
Таким образом, стволовые клетки - больше, чем обычные клетки. Они дают возможность - впервые в истории человечества - манипулировать индивидуальным геномом in vitro. С открытием стволовых клеток оборвалась необратимая линейная траектория онтогенеза человека.
Ключевые вопросы для дискуссии
Многие вопросы вокруг статуса взрослых ПСК остаются в дискуссионном поле. Непонятно, например, каково предназначение резервных плюрипотентных клеток взрослых тканей в организме человека? Пока нет оснований предполагать, что эти уникальные по генетической потенции клетки реально используются для репарации или каких-либо других целей в постнатальном периоде жизни человека. Зачем эволюция создала этот уникальный дубликат стволовых клеток?
Идентичен ли статус плюрипотентных стволовых клеток взрослого человека, сохраняющихся в органах, с качеством клеток, размноженных в лабораторной посуде? Где проходит граница индивидуального организма, если в лаборатории возможно получение запасных частей из клеток его генома? Ведь стволовые клетки обеспечивают будущее в виде новых поколений клеток. Является ли банк замороженных стволовых клеток законной частью территории живущего организма? Могут ли ПСК с помощью лабораторного эмбриогенеза переносить уникальные специфические черты индивидуального генома в лабораторную жизнь клеток? Как определять лабораторную жизнь клеток индивидуума?
Правомочно и этично ли создавать лабораторные дублеры наших взрослых ПСК с познавательной и прикладной целью?
Как найти оптимальный баланс между медицинской помощью и риском возможных осложнений за счет непредсказуемого поведения донорских СК в организме пациента?
Возникают и другие проблемы. Например, необходим ли новый биологический и биоэтический статус Homo sapiens в эру беспрецедентных инвазивных клеточных технологий, буквально преобразующих клеточную карту и "биопаспорт" индивидуальной жизни и личности?
Как соотносятся фенотипические признаки индивидуальности в клетках in situ и клетках in vitro? До какой степени неизбежны, научно и морально обоснованы эксперименты с клетками вне человека - их собственника?
Имеет ли современный человек моральное и юридическое право создавать новую экспериментальную платформу из лабораторных стволовых клеток с целью расширения территории органов и времени существования индивидуальной жизни? Целесообразны ли поиски рекапитуляции индивидуальной жизни через лабораторное копирование? И что морально допустимо в попытках запустить индивидуальную жизнь от генетического потенциала взрослых СК?
Биологические перспективы
Огромный прогресс в понимании роли ЭСК и ПСК в пре- и пост-натальной жизни привел, как говорилось выше, к существенному пересмотру старой догмы относительно линейности и необратимости важнейших этапов онтогенеза человека. Теперь схема индивидуального развития из линейных необратимых стадий превратилась в повторяющиеся циклы обновления клеток, интегрированные в согласованную программу. В зародышах циклы обновления клеток на порядок более интенсивны, чем во взрослых органах.
В соответствии с последними экспериментальными данными клеточную платформу индивидуальной жизни следует рассматривать, скорее, как гибкий постоянно обновляющийся клеточный каркас. Клетки приходят и уходят, но территория организма остается неизменной. Периодическая смена соматических клеток за счет резерва стволовых клеток, судя по всему, - главный механизм, защищающий организм от заболеваний и ускоренного старения. Разные органы отличаются разным темпом обновления клеток и истощения пула региональных стволовых клеток (разной скоростью биологического старения).
Сегодня можно рассматривать онтогенез как циклы клеточных событий, которые возможно повторить, расширить, сократить или репрограммировать с помощью внутренних ресурсов стволовых клеток. Молекулярные или генетические ошибки внутриутробного или постнатального развития могут купироваться пересадками здоровых клеток. Общая численность клеток организма, их локализация, границы органов, функциональные возможности организма - все эти параметры модулируются в ходе адаптации и в зависимости от потребностей организма.
В отличие от оплодотворенной яйцеклетки, имеющей лишь одну заданную траекторию развития, ЭСК и ПСК наделены гибкими альтернативными программами развития. Хотя в реальных условиях организма каждая клетка имеет лишь "one way ticket" ("билет в одну сторону"), общий потенциал стволовых клеток организма позволяет обращать вспять до сих пор необратимые химические повреждения ДНК и клеточных органелл.
Практические возможности индивидуального генома на уровне потенций ЭСК и ПСК только начинают осмысляться. Но уже очевидно, что расшифровка направленного репрограммирования стволовых клеток в культуре открывает дорогу в медицину ближайшего будущего.
Биоэтические перспективы
Биология в лице частного бизнеса с широким размахом инвестирует финансы и человеческие ресурсы в многостороннее изучение геномных и клеточных основ индивидуальной жизни человека. Эта новая биология существенно отличается от классических популяционных исследований, определения средних величин и вариабельности различных признаков. ЭСК и ПСК заставили искать молекулярные отпечатки индивидуальности не только в ДНК, но и в мире белков, а также на клеточном, тканевом и органном уровне. От статистических прогнозов и маркеров болезни в популяции медицина нашего столетия стремительно движется к личности больного, к учету особенностей его гено- и фенотипа.
Однако эта перспективная область биологии, естественно, претерпевает болезни роста и становления, особенно там, где наука стыкуется с бизнесом. Попытки ужесточения государственного контроля вокруг СК пока давали лишь обратный результат. Простые запрещения или временный мораторий стимулировали частный бизнес, в первую очередь в лице наиболее продвинутых транснациональных корпораций (ТНК). Закрытый, полуконфиденциальный вариант развития ТНК-биологии сфокусирован не на скорейший прогресс общества, а на извлечение максимальной прибыли из научных открытий. Интересы ТНК направлены на проведение первых клинических испытаний СК в наименее развитых странах с упрощенным режимом проверок на безопасность и биологическую активность. Клинические испытания в этих странах, как правило, проводятся в условиях, когда правительства практически лишены возможности контролировать ход и качество испытаний.
Очевидно, что новые законодательные инициативы, которые выдвигаются в развитых государствах, должны разрабатываться высококвалифицированными экспертами, в обстановке полной прозрачности и публичности, с учетом интересов всех слоев населения. Новые нормативы должны защищать и поддерживать научный прогресс и полезные технологии во имя интересов общества, а не частного бизнеса, контролируя при этом безопасность и лечебную эффективность нового рынка медицинских услуг. Неконтролируемый или плохо контролируемый бизнес в области стволовых клеток во многих странах мира - болевой сигнал и четкий индикатор нерешенных проблем. Только сильное государство и его институты способны защитить интересы и права пациентов, открывая дорогу новым возможностям науки.
Законодательство высокоразвитых стран с намеренной отсрочкой реагирует на новые вызовы и конфликты интересов личности и общества, создателей новшеств и их потребителей. Накопленные полярные мнения и интересы государство стремится перебросить в поле публичных дебатов. Обществу нужно время, чтобы созреть для новых консолидирующих решений, которые со временем приобретут форму законов.